Indicado para o tratamento de pacientes adultos com mieloma múltiplo, o anticorpo isatuximabe (Sarclisa®, da Sanofi Genzyme) recebeu dia 20 de outubro a liberação da Câmara de Regulação do Mercado de Medicamentos (CMED), que definiu o preço de comercialização no Brasil. O novo agente é indicado para pacientes adultos com mieloma múltiplo recidivado e refratário que receberam pelo menos duas linhas anteriores de tratamento, incluindo lenalidomida e um inibidor de proteassoma, e demonstraram progressão da doença na última terapia.
A aprovação de isatuximabe no Brasil foi autorizada em março pela Anvisa, com base nos resultados do ensaio de Fase III ICARIA. Neste estudo randomizado internacional (NCT02990338), isatuximabe mostrou benefício clínico significativo em combinação com pomalidomida e dexametasona, com redução de 40% no risco de progressão da doença ou morte em pacientes politratados. A mediana de sobrevida livre de progressão foi de 11,53 meses versus 6,47 meses, demonstrando a superioridade de isatuximabe frente ao braço controle (HR 0,596; 95% CI: 0,44-0,81; p = 0,001).
“A adição de isatuximabe à pomalidomida-dexametasona melhora significativamente a sobrevida livre de progressão em pacientes com mieloma múltiplo recidivado e refratário, representando uma nova e importante opção de tratamento para essa população, principalmente para pacientes que se tornam refratários à lenalidomida e a um inibidor de proteassoma”, concluíram os autores.
Indicado para o tratamento de pacientes adultos com mieloma múltiplo, o anticorpo isatuximabe (Sarclisa®, da Sanofi Genzyme) recebeu dia 20 de outubro a liberação da Câmara de Regulação do Mercado de Medicamentos (CMED), que definiu o preço de comercialização no Brasil. O novo agente é indicado para pacientes adultos com mieloma múltiplo recidivado e refratário que receberam pelo menos duas linhas anteriores de tratamento, incluindo lenalidomida e um inibidor de proteassoma, e demonstraram progressão da doença na última terapia.
A aprovação de isatuximabe no Brasil foi autorizada em março pela Anvisa, com base nos resultados do ensaio de Fase III ICARIA. Neste estudo randomizado internacional (NCT02990338), isatuximabe mostrou benefício clínico significativo em combinação com pomalidomida e dexametasona, com redução de 40% no risco de progressão da doença ou morte em pacientes politratados. A mediana de sobrevida livre de progressão foi de 11,53 meses versus 6,47 meses, demonstrando a superioridade de isatuximabe frente ao braço controle (HR 0,596; 95% CI: 0,44-0,81; p = 0,001).
“A adição de isatuximabe à pomalidomida-dexametasona melhora significativamente a sobrevida livre de progressão em pacientes com mieloma múltiplo recidivado e refratário, representando uma nova e importante opção de tratamento para essa população, principalmente para pacientes que se tornam refratários à lenalidomida e a um inibidor de proteassoma”, concluíram os autores.
Na ASCO 2021, isatuximabe apresentou novos dados no tratamento de pacientes com mieloma múltiplo, desta vez como parte do regime com carfilzomibe e dexametasona, avaliado no estudo de Fase III IKEMA (NCT03275285). Nesta análise, os pesquisadores avaliaram a eficácia e segurança de isatuximabe de acordo com o número de linhas de tratamento (1 vs > 1) e refratariedade à lenalidomida ou bortezomibe. O estudo tem participação brasileira, dos hematologistas Ângelo Maiolino, da Universidade Federal do Rio de Janeiro (UFRJ), Marcelo Capra, do Centro Integrado de Hematologia e Oncologia do Hospital Mãe de Deus, em Porto Alegre, e Edvan Crusoe do CEHON – Centro de Hematologia e Oncologia da Bahia. Ao todo, cinco centros brasileiros participaram do estudo.
Os resultados apresentados na ASCO 2021 demonstram que o regime de tratamento com isatuximabe (Isa) mais carfilzomibe e dexametasona (Kd) melhorou significativamente a sobrevida livre de progressão (SLP) em pacientes com mieloma múltiplo recidivado (HR 0,53; 99% CI 0,32–0,89; P = 0,0007). A adição de Isa a carfilzomibe e dexametasona também melhorou a profundidade da resposta e as taxas de resposta completa na população avaliada.
“A adição de Isa a Kd melhorou a SLP e a profundidade da resposta, independentemente das linhas de tratamento anteriores ou estado refratário, resultados consistentes com o benefício observado na população geral do estudo IKEMA, com perfil de segurança gerenciável. Isa-Kd é uma nova opção de tratamento para MM, em particular para a população de pacientes refratária a lenalidomida", concluíram os autores.
Isatuximabe é um anticorpo monoclonal derivado de IgG1 que se liga a um epítopo extracelular específico do receptor CD-38 e desencadeia vários mecanismos que levam à morte de células tumorais que expressam CD-38.
ICARIA Trial cumpre endpoint primário e apoia registro e comercialização de isatuximabe no Brasil
O ensaio ICARIA-MM (NCT02990338) é um estudo internacional de Fase III, multicêntrico, randomizado, aberto, envolvendo 102 hospitais em 24 países da Europa, América do Norte, Ásia e Pacífico.
Foram elegíveis 307 pacientes com mieloma múltiplo recidivado e refratário que receberam pelo menos duas terapias anteriores, incluindo lenalidomida e um inibidor de proteassoma. Os pacientes foram randomizados (1: 1) para receber isatuximabe (10 mg / kg) mais pomalidomida (4 mg) mais dexametasona (40 mg; 20 mg para pacientes com idade ≥75 anos) ou pomalidomida 4 mg mais dexametasona 40 mg. A estratificação considerou o número de linhas de tratamento prévio (2-3 vs> 3) e a idade dos pacientes (<75 anos vs ≥75 anos).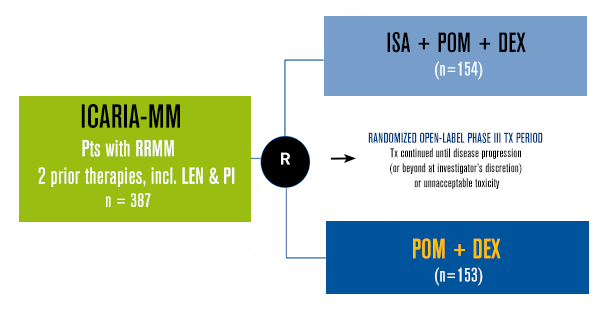
O endpoint primário foi demonstrar o benefício de isatuximabe na sobrevida livre de progressão (SLP) avaliada por um comitê independente, com base em dados laboratoriais e de imagem radiológica. A análise foi realizada pelo método Kaplan-Meier e utilizou critérios do International Myeloma Working Group (IMWG). A segurança foi avaliada em todos os participantes que receberam pelo menos uma dose do medicamento do estudo.
O grupo isatuximabe-pomalidomida-dexametasona recebeu isatuximabe por via intravenosa nos dias 1, 8, 15 e 22 no primeiro ciclo de 28 dias, depois nos dias 1 e 15 nos ciclos subsequentes, até progressão da doença, toxicidade inaceitável ou retirada do consentimento (exposição máxima: 76,7 semanas).
Resultados
Entre 10 de janeiro de 2017 e 2 de fevereiro de 2018, 307 pacientes foram randomizados para o grupo de tratamento com isatuximabe (n= 154) ou para o grupo controle, com pomalidomida-dexametasona (n= 153). Da população avaliada (mediana de 68 anos; 58% homens), 66% foram expostos a 2 ou 3 linhas de tratamento prévio; 284 (93%) eram refratários a lenalidomida, 181 (59%) refratários a lenalidomida como última linha de tratamento e 233 (76%) refratários ao último inibidor de proteassoma. Um total de 60 pacientes (20%) apresentavam citogenética de alto risco e 104 (36%) tinham comprometimento da função renal.
Os primeiros dados de eficácia e segurança foram reportados por Attal e colegas (Lancet, 2019). Em um seguimento mediano de 11, 6 meses (IQR 10,1–13,9), isatuximabe cumpriu o endpoint primário e mostrou sobrevida livre de progressão significativamente superior (11,5 meses, 95% CI 8,9–13,9) na comparação com o grupo controle (6,5 meses, 4,5–8,3); hazard ratio 0,596, 95% CI 0·44–0·81; p=0,001).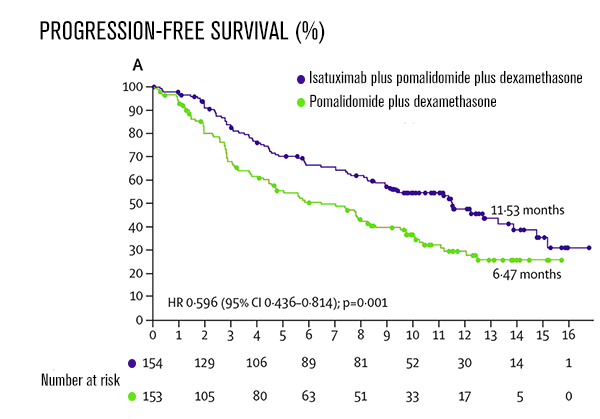
Os resultados demonstraram benefício de SLP com isatuximabe em todos os subgrupos, incluindo pacientes com citogenética de alto risco, idosos acima de 75 anos, pacientes com função renal comprometida, que receberam mais de três linhas de tratamento anteriores, pacientes refratários a lenalidomida e a um inibidor de proteassoma.
Quando avaliada a resposta, mais pacientes tratados com isatuximabe alcançaram resposta parcial (60% vs 35%; p <0 0001) ou melhor resposta parcial (32% vs 9%; p <0 0001). No grupo tratado com o anti CD-38, as respostas foram mais rápidas e mais duráveis. O tempo médio para a primeira resposta em pacientes com resposta parcial ou melhor resposta foi de 35 dias versus 58 dias no grupo controle. A duração mediana de resposta foi de 13, 3 meses (IC 95% 10 6 - não calculável) versus 11 meses (8,5 - não calculável) no grupo pomalidomida-dexametasona.
Análise de subgrupo publicada por Bringhen et al. (Leuk Res. 2021) corroborou a base de evidências sobre o benefício de isatuximabe, demonstrando ganho de SLP em pacientes que receberam 2-3 linhas de tratamento (12,3 vs 7,8 meses) e também naqueles expostos a mais de 3 linhas de tratamento prévio (9,4 vs. 4,3 meses).
O tratamento com isatuximabe também mostrou benefício de SLP no subgrupo primariamente refratário à lenalidomida (11,6 vs. 5.7 meses), em pacientes refratários a lenalidomida na última linha (11,4 vs. 5,6 meses), no subgrupo refratário a um inibidor de proteassoma (11,4 vs. 5,6 meses) e em pacientes com dupla refratariedade (11,2 vs. 4,8 meses).
Na análise de Bringhen e colegas, a taxa de resposta objetiva (ORR) em pacientes tratados com isatuximabe foi de 59,0 % versus 31,4 % em pacientes refratários à lenalidomida e de 60,2 % versus 32,2 % naqueles refratários a um inibidor de proteassoma (IP). Mesmo em pacientes refratários a lenalidomida ou IP; isatuximabe mostrou superioridade frente ao grupo controle (58,6 % vs 29,9 %).
Em relação à segurança, a combinação baseada em isatuximabe foi geralmente bem tolerada e demostrou perfil manejável de eventos adversos. Os eventos mais frequentes (qualquer grau) com isatuximabe versus controle foram reações à infusão (38% vs 0), infecções do trato superior (28% vs 17%) e diarreia (26% vs 20%). Eventos adversos com desfecho fatal foram relatados em 12 pacientes (8%) no grupo isatuximabe-pomalidomida-dexametasona e em 14 (9%) no grupo pomalidomida-dexametasona. Mortes por eventos adversos relacionados ao tratamento ocorreram em um paciente (<1%) no grupo experimental (sepse) e em dois (1%) pacientes no grupo controle (pneumonia e infecção do trato urinário).
Em conclusão, a adição de isatuximabe à pomalidomida – dexametasona melhora significativamente a sobrevida livre de progressão em pacientes com mieloma múltiplo recidivado e refratário. O anti CD-38 isatuximabe é uma nova e importante opção para o tratamento de mieloma múltiplo, principalmente para pacientes que se tornam refratários à lenalidomida e a um inibidor de proteassoma.
Sobre o mesmo assunto, assista a vídeo exclusivo da TV Onconews com os hematologistas Ângelo Maiolino e Marcelo Capra:
Referências:
- DIÁRIO OFICIAL DA UNIÃO - Publicado em: 29/03/2021 | Edição: 59 | Seção: 1 | Página: 126
- Attal, M., Richardson, P. G., Rajkumar, S. V., San-Miguel, J., Beksac, M., Spicka, I., … Dimopoulos, M. A. (2019). Isatuximab plus pomalidomide and low-dose dexamethasone versus pomalidomide and low-dose dexamethasone in patients with relapsed and refractory multiple myeloma (ICARIA-MM): a randomised, multicentre, open-label, phase 3 study. The Lancet. doi:10.1016/s0140-6736(19)32556-5
- FDA approves isatuximab-irfc for multiple myeloma
- European Medicines Agency – Sarclisa
- Abstract 8034: Isatuximab plus carfilzomib and dexamethasone in patients with relapsed multiple myeloma according to prior lines of treatment and refractory status: IKEMA subgroup analysis. - Roman Hajek et al.
- Bringhen S, Pour L, Vorobyev V, Vural F, Warzocha K, Benboubker L, Koh Y, Maisnar V, Karlin L, Pavic M, Campana F, Le Guennec S, Menas F, van de Velde H, Richardson PG. Isatuximab plus pomalidomide and dexamethasone in patients with relapsed/refractory multiple myeloma according to prior lines of treatment and refractory status: ICARIA-MM subgroup analysis. Leuk Res. 2021 May;104:106576. doi: 10.1016/j.leukres.2021.106576. Epub 2021 Mar 29. PMID: 33839618








