A doença veno-oclusiva (DVO) hepática, também chamada de síndrome de obstrução sinusoidal (SOS), é uma complicação potencialmente fatal do transplante de células-tronco hematopoiéticas (TCTH), associada a mais de 90% de mortalidade nos casos graves1. É nesse contexto que os resultados de eficácia e segurança de defibrotida (Defitelio®, Zodiac) marcam benefício sem precedentes em pacientes com DVO estabelecida, demonstrando sobrevida superior nessa população de pacientes em relação ao controle histórico2.
A eficácia e segurança de defibrotida foi avaliada em 528 pacientes tratados em três estudos: dois ensaios clínicos prospectivos e um estudo de acesso expandido4. O principal endpoint de eficácia foi a sobrevida no dia 100 (Dia+100) pós-TCTH. Os resultados reportados mostram que a taxa de sobrevida pós-TCTH foi de 38% (95% CI: 29% a 48%; P = 0,01), 44% (95% CI: 33% a 55%) e 45% (95% CI: 40% a 51%), respectivamente, demonstrando que o novo agente realmente cumpriu o endpoint primário.
A doença veno-oclusiva (DVO) hepática, também chamada de síndrome de obstrução sinusoidal (SOS), é uma complicação potencialmente fatal do transplante de células-tronco hematopoiéticas (TCTH), associada a mais de 90% de mortalidade nos casos graves1. É nesse contexto que os resultados de eficácia e segurança de defibrotida (Defitelio®, Zodiac) marcam benefício sem precedentes em pacientes com DVO estabelecida, demonstrando sobrevida superior nessa população de pacientes em relação ao controle histórico2.
A eficácia e segurança de defibrotida foi avaliada em 528 pacientes tratados em três estudos: dois ensaios clínicos prospectivos e um estudo de acesso expandido4. O principal endpoint de eficácia foi a sobrevida no dia 100 (Dia+100) pós-TCTH. Os resultados reportados mostram que a taxa de sobrevida pós-TCTH foi de 38% (95% CI: 29% a 48%; P = 0,01), 44% (95% CI: 33% a 55%) e 45% (95% CI: 40% a 51%), respectivamente, demonstrando que o novo agente realmente cumpriu o endpoint primário.
O primeiro estudo é um ensaio de Fase 3 com controle histórico (Richardson et al., 2016)2 que avaliou 102 pacientes (44 crianças e 58 adultos) com diagnóstico de DVO. Foram considerados pacientes com bilirrubina ≥ 2 mg/dL e pelo menos dois dos seguintes critérios: hepatomegalia, ascite e ganho de peso (superior a 5% no Dia +21 pós-TCTH), além de disfunção de múltiplos órgãos (pulmonar, renal ou ambas) até Dia+28 pós-TCTH. No Estudo 2, que determinou a dose máxima tolerada (Richardson et. al., 2010)3, foram inscritos 75 pacientes adultos e pediátricos com diagnóstico de DVO hepática e disfunção de múltiplos órgãos pós-TCTH. No terceiro estudo, de acesso expandido4, a eficácia de defibrotida foi avaliada em 351 pacientes adultos e pediátricos que receberam TCTH e desenvolveram DVO hepática com disfunção renal ou pulmonar.
Richardson e colegas reportaram os resultados de Fase 3 na Blood em 2016, mostrando benefício de 23% na sobrevida do Dia +100 após o transplante de células hematopoiéticas em comparação com o controle histórico. O estudo de Fase 3 também mostrou 19% na diferença estimada da resposta completa para o Dia +100 pelo escore de propensão (IC de 95%, 3,5% a 34,6%; P = 0,0160)2.
Em relação ao perfil de segurança, defibrotida foi bem tolerado, com toxicidade manejável. Os eventos adversos (EAs) relacionados ao tratamento incluíram hemorragia ou hipotensão. No entanto, a incidência de EAs hemorrágicos (incluindo alveolar pulmonar [11,8% e 15,6%] e sangramento gastrointestinal [7,8% e 9,4%]) foi semelhante entre os grupos de defibrotida e controle.
Com base nesses resultados a agência norte-americana aprovou em março de 2016 o uso de defibrotida no tratamento de pacientes adultos e pediátricos com doença veno-oclusiva hepática5. No Brasil, o medicamento foi aprovado pela Agência Nacional de Vigilância Sanitária (ANVISA) em março de 2019 para o tratamento de pacientes com DVO com disfunção renal ou pulmonar após transplante de células-tronco hematopoiéticas (TCTH)6.
O TCTH é o padrão de tratamento em diferentes malignidades hematológicas. Estimativas do INCA7 apontaram 23.510 novos casos de neoplasias hematológicas (incluindo linfomas e leucemias) por 100 mil habitantes no Brasil em 2018. As leucemias estão entre as 10 neoplasias mais incidentes em homens no País, correspondendo a 5940 casos, e aparecem como a décima malignidade mais incidente em mulheres brasileiras, com 4860 casos.
Fatores de risco, diagnóstico e avaliação prognóstica em adultos
A doença veno-oclusiva hepática (DVO) ou síndrome obstrutiva sinusoidal (SOS) é um espectro de síndromes de lesão de órgãos que pode ocorrer após a quimioterapia de altas doses empregadas no transplante de células-tronco hematopoiéticas (TCTH). Caracteriza-se por hepatomegalia, dor abdominal no quadrante superior direito, hiperbilirrubinemia, ascite e ganho de peso8.
Classificação de risco proposta pela European Society for Blood and Marrow Transplantation - (EBMT, 2016)9 lembra que existem três tipos diferentes de fatores de risco para DVO: aqueles diretamente relacionados ao transplante, os relacionados às características do paciente e à doença de base e, por fim, os fatores de risco hepáticos. A apresentação clínica difere entre adultos e crianças, com distinções que somente em período recente foram incorporadas à prática clínica.
Em resposta à atual base de evidências, recomendações específicas foram publicadas para a população pediátrica10 (Leia DVO em pediatria, reconhecendo as diferenças).
Para classificar a gravidade da DVO em pacientes adultos e orientar as decisões terapêuticas, os novos critérios da EBMT consideram o nível de bilirrubina e sua taxa de alteração, função hepática (transaminase), aumento de peso, função renal e a cinética de seu início (Tabela 1)
Esse novo olhar sobre a cinética do aparecimento dos sintomas está entre as principais mudanças incorporadas aos critérios atuais. “Na verdade, o risco de desenvolver DVO grave em um paciente cujo nível de bilirrubina sérica aumenta de 3 para 6 mg / dL em 48 horas é maior do que em um paciente que atinge esse nível por um período mais longo. Portanto, decidimos levar em consideração a cinética da bilirrubina em nosso sistema de classificação de risco. A duplicação do nível sérico em 48 horas é um critério para classificar a DVO como grave”, define a EBMT.
A mesma dinâmica vale para avaliar a função renal a partir dos níveis de creatinina sérica, conforme proposto nos critérios EBMT. A nova classificação leva em conta que um paciente cujos sintomas surgem logo após o TMO tem muito mais probabilidade de desenvolver DVO grave do que aquele cujos sintomas surgem em período posterior.
Amplamente descrito na literatura, o aumento de peso é outro fator de risco para DVO e pode refletir o desenvolvimento de ascite, diretamente correlacionada com a gravidade do processo fisiopatológico da DVO. Assim, um ganho de 5% ou 10% do peso corporal é um critério para classificar DVO como moderada/grave ou muito grave, respectivamente. No entanto, o aumento de peso deve ser avaliado após tratamento diurético ideal, recomenda a EBMT.
A presença de doença avançada também concorre para aumentar o risco de DVO, assim como estão em maior risco de DVO pacientes com talassemia e doença hepática pré-existente.
TABELA 1.
|
New EBMT criteria for severity grading of a suspected SOS/VOD in adults |
||||
|
Milda |
Moderatea |
Severe |
Very severe - MOD/MOFb |
|
|
Time since first clinical |
> 7 Days |
5-7 Days |
≤ 4 Days |
Any time |
|
Bilirubin (mg/dL) |
≥ 2 and < 3 |
≥ 3 and < 5 |
≥ 5 and < 8 |
≥ 8 |
|
Bilirubin (μmol/L) |
≥ 34 and < 51 |
≥ 51 and < 85 |
≥ 85 and < 136 |
≥ 136 |
|
Bilirubin kinetics |
Doubling within 48 h |
|||
|
Transaminases |
≤ 2 x normal |
> 2 and ≤ 5 x normal |
> 5 and ≤ 8 x normal |
> 8 x normal |
|
Weight increase |
< 5% |
≥ 5% and < 10% |
≥ 5% and < 10% |
≥ 10% |
|
Renal function |
< 1.2 x Baseline at transplant |
≥ 1.2 and < 1.5 x Baseline at transplant |
≥ 1.5 and < 2 x Baseline at transplant |
≥ 2 x Baseline at transplant |
|
Abbreviations: EBMT = European society for Blood and Marrow Transplantation; MOD = multi-organ dysfunction; MOF = multi-organ failure;
|
||||
Na era da genômica, fatores genéticos já foram descritos por sua associação com o risco de DVO grave e estão incorporados à nova classificação, como o genótipo nulo para GSTM1, +a presença do alelo C282Y da hemocromatose, além do haplótipo MTHFR 677CC / 1298CC em pacientes que recebem regime de condicionamento mieloablativo com bussulfano oral.
Na definição prognóstica proposta pela EBMT, pacientes que preenchem dois ou mais critérios de risco (nível de bilirrubina, cinética da bilirrubina, função hepática, aumento de peso, função renal e cinética dos sintomas) em duas categorias diferentes devem ser classificados na categoria mais grave.
Também de mau prognóstico são os pacientes com falência de múltiplos órgãos. Dentro dos novos critérios, a insuficiência renal é definida como creatinemia ⩾2 vezes a linha de base no momento do transplante, ou depuração da creatinina a 50% do nível do transplante, ou diálise. A insuficiência pulmonar é definida como saturação de oxigênio ⩽90% em ar ambiente e / ou necessidade de pressão positiva / dependência do ventilador. Sintomas neurológicos sugestivos de falência do sistema nervoso central incluem confusão, letargia e / ou delírio não atribuíveis a qualquer outra causa.
Ao lado das características individuais, fatores de risco relacionados ao transplante são igualmente descritos na base de evidências. De acordo com a classificação da EBMT eles estão diretamente relacionados com a escolha da intensidade do regime de condicionamento, o tipo de doador e até mesmo com a profilaxia empregada para a doença do enxerto contra o hospedeiro (GvHD). O risco de DVO é maior após o transplante alogênico (alo-HCT) em comparação com o transplante autólogo, embora o alo-HCT não possa por si só ser considerado fator de risco. Em vez disso, os autores alertam para as situações em que a alorreatividade do transplante é aumentada (uso de um doador não aparentado ou HLA incompatível; enxerto sem depleção de linfócitos T).
Além de variar conforme o regime de condicionamento, o risco de DVO também depende dos medicamentos empregados. Evidências indicam que é maior após bussulfano de altas doses ou condicionamento mieloablativo convencional baseado em regime de irradiação corporal total (TBI) comparado ao condicionamento de intensidade reduzida.
Finalmente, o segundo allo-HCT também deve ser considerado como importante fator de risco para o desenvolvimento da DVO.
Assim, os novos critérios de classificação de risco da EBMT são uma ferramenta valiosa para avaliar com precisão a gravidade no momento do diagnóstico, em vez de apenas retrospectivamente, permitindo identificar e quantificar mais precocemente a DVO para auxiliar na seleção de pacientes que requerem intervenção terapêutica imediata.

Dados sobre novas modalidades de imagem não foram incorporados à atualização de 2016. Diante da ausência da validação, o papel da imagem na DVO permaneceu limitado à ultrassonografia para auxiliar na exclusão de diagnósticos diferenciais. Além disso, a EBMT observa que a ultrassonografia pode ser útil para confirmar achados clínicos, como hepatomegalia e ascite, que podem ser difíceis de avaliar em pacientes com sobrepeso.
Historicamente, o manejo da DVO envolvia principalmente cuidados de suporte (diuréticos, diálise e oxigênio) e uso de anticoagulantes ou antifibrinolíticos, com eficácia limitada e efeitos adversos significativos, como sangramento fatal com heparina ou ativador do plasminogênio tecidual. Agora, evidências sustentam que o tratamento com defibrotida é um divisor de águas, possivelmente por sua ação na proteção endotelial e na restauração do equilíbrio trombofibrinolítico.
A importância de intervenções precoces já foi demonstrada e a publicação da EBMT lembra que qualquer atraso no diagnóstico, mesmo além de 1 dia, resulta em um tratamento mais longo e menos eficaz, com impacto na redução de sobrevida global. Inversamente, o diagnóstico imediato, apoiado pelos novos critérios, reforça a importância de reconhecer o risco individual antes do transplante para abordar fatores gerenciáveis (por exemplo o protocolo de condicionamento) e em casos selecionados considerar a profilaxia.
Em síntese, a implementação da profilaxia e do tratamento imediato com defibrotida pode melhorar significativamente os resultados dos pacientes no que diz respeito à morbidade, gravidade da DVO, hospitalização e mortalidade.
DVO em pediatria, reconhecendo as diferenças
Na última década, os critérios de Seattle e de Baltimore foram usados no diagnóstico de DVO, em adultos e crianças. Agora, diante do crescente corpo de evidências, é impossível deixar de reconhecer diferenças significativas entre a população adulta e pediátrica quanto à incidência, predisposição genética e apresentação clínica, além de distinções em aspectos como profilaxia e resultados de tratamento.
Para dar respostas às particularidades dessa população de pacientes, a EBMT definiu critérios distintos em uma edição específica para o paciente pediátrico (pEBMT), publicada em junho de 2017. A principal intenção dos critérios pEBMT foi estimular a intervenção precoce com defibrotida, reunindo evidências de benefício clínico significativo, além de enfatizar as especificidades do paciente pediátrico.
Em publicação na Nature em 2020, Szmit et al. destacam que a incidência de DVO é de aproximadamente 13,7% em pacientes adultos, mas pode ser três vezes maior entre as crianças, alcançando até 60% em certas populações de alto risco. Embora a hiperbilirrubinemia ⩾2 mg / dL seja um marcador aparentemente objetivo de DVO, com frequência de 100% em adultos com DVO, ensaio randomizado de Fase III envolvendo pacientes pediátricos mostrou que a DVO anictérica foi observada em 32% dos pacientes, incluindo aqueles com doença grave12.
Dados reportados por um programa internacional de uso compassivo mostram resultado superior em crianças na comparação com adultos, assim como foi a população pediátrica a primeira a evidenciar o benefício da intervenção precoce com defibrotida.
E as especificidades vão além. Em crianças, a DVO pode ocorrer fora do contexto de TMO, associada ao tratamento com químio/radioterapia e em 20% dos casos se desenvolve mais de 30 dias após o TCTH (tabela 2). O diagnóstico é essencialmente clínico, com presença de dois ou mais sintomas: trombocitopenia refratária; ganho de peso por 3 dias consecutivos apesar do uso de diuréticos ou ganho de peso 45% maior que o do baseline; hepatomegalia confirmada por imagem; ascite (confirmada por imagem e aumento da bilirrubina por 3 dias consecutivos ou bilirrubina⩾2 mg/dL em 72 horas (tabela 3). Marcadores biológicos específicos e ferramentas de imagem são auxiliares importantes.
TABELA 2.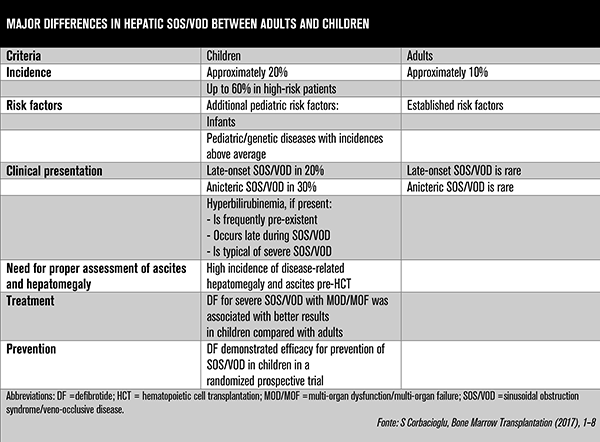
TABELA 3.
A nova classificação proposta para a população pediátrica lembra que os fatores de risco relacionados ao TMO são comumente associados ao regime pré-transplante, incluindo o uso de anticorpos ligados à ozogamicina (gemtuzumab e inotuzumab), além do regime de condicionamento conhecido por ser tóxico para o endotélio (como bussulfano de altas doses em fração única ou em frações de altas doses (⩾12 Gray), condicionamento mieloablativo convencional baseado em TBI, ou, ainda, combinação de bussulfano e ciclofosfamida e / ou melfalano).
Riscos associados ao paciente também são destacados nas recomendações da pEBTM, considerando que patologias mais comuns na infância ampliam o risco de DVO nessa população. É o caso da osteopetrose, condição em que a incidência de DVO chega a atingir 60%; em síndromes congênitas de ativação de macrófagos, como a linfo-histiocitose hemofagocítica familiar, Griscelli e síndrome linfoproliferativa ligada ao X, em que a incidência de DVO é de 30%.
Pacientes com talassemia com hepatomegalia e alta sobrecarga de ferro também integram a população de risco, com incidência relatada de 30-40%, assim como aqueles com neuroblastoma tratados com quimioterapia de altas doses e TCTH autólogo, geralmente após condicionamento com bussulfano. “Comparada com a incidência de 5% de DVO após transplante autólogo em adultos, a incidência relatada de 15-30% em crianças com neuroblastoma é extremamente alta”, analisa a classificação da pEBTM, que também relata maior risco de DVO em crianças com tumor de Wilms, rabdomiossarcoma e tumores cerebrais, particularmente as que receberam terapias de combinação incluindo actinomicina D.
TABELA 4.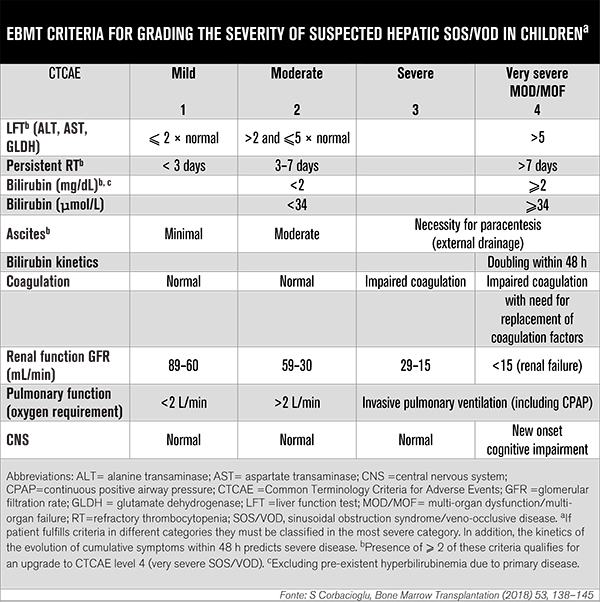
Impacto
Análise prospectiva avaliou a utilidade dos critérios EBMT pediátricos (pEBMT) para o diagnóstico de DVO e mostrou seu impacto na relação custo-benefício e nos resultados dos pacientes. O estudo incluiu 282 crianças e adolescentes que realizaram TCTH entre janeiro de 2016 e março de 2019 no Departamento de Hematologia Pediátrica, Oncologia e Transplante de Medula Óssea da Wroclaw Medical University, Polônia. Os participantes tinham entre 2 meses e 21 anos de idade (mediana: 7,6 anos) e realizaram transplante alogênico (n = 209) ou autólogo (n = 73).
Os autores compararam os dados de DVO dessa coorte com os dados coletados no mesmo centro, de 2001 a 2015, quando 48 pacientes desenvolveram DVO entre os 951 tratados com TCTH - todos avaliados antes da nova classificação.
Na coorte atual, 25 (8,9%) pacientes pediátricos (idade mediana 3,5 anos) foram diagnosticados com DVO. A duração da administração de defibrotida na dose de 25 mg/kg/dia variou de 4 a 34 dias (mediana: 16,5), com taxa de resposta de 96%. Não houve uso profilático. A sobrevida global foi de 88%, indicando avanços importantes depois de implementar os novos critérios de classificação. Se aplicados os critérios de Baltimore e de Seattle modificados, a incidência de DVO seria de 2,13% e 5,7%, respectivamente, implicando em atrasos no tratamento e custos desnecessários. Antes de 2016, a incidência de DVO era de 4,9%, com taxa de resposta a defibrotida de 74% (p = 0,033) e SG de 56,2% (p = 0,008).
Depois de implementar novos critérios, o tempo de internação para pacientes com DVO diminuiu em mediana de 12 dias (p = 0,009). O diagnóstico facilitado pelos critérios EBMT e a implementação de tratamento imediato concorreram para melhorar significativamente o resultado do paciente, com ganho de sobrevida global, além de reduzir tanto o tempo de administração de defibrotida, quanto o tempo de internação hospitalar.
Nesta mesma coorte, Szmit et al. reportam que o diagnóstico de DVO em uma população pediátrica foi em média 16 dias após o TCTH, com cinco casos (20%) diagnosticados 21 dias após o transplante. Os autores descrevem que a trombocitopenia refratária foi o primeiro e mais consistente sintoma de DVO, observado em 100% das crianças e jovens avaliados. Outros sinais clínicos foram ascite confirmada por ultrassonografia (76%), hepatomegalia e ganho de peso, todos observados em 23 pacientes (92%), respectivamente. Nenhum desenvolveu fluxo sanguíneo reverso na veia porta.
Apenas cinco (20%) pacientes apresentaram hiperbilirrubinemia > 2 mg / dl no diagnóstico, enquanto 17 (68%) preencheram o critério de aumento na bilirrubina sérica em três dias consecutivos. O nível mediano de bilirrubina ao diagnóstico foi de 1,2 mg / dl (intervalo de 0,4 mg / dl – 4,5 mg /dl). O pico do nível de bilirrubina na coorte de DVO variou de 0,4–20,3 mg / dl (mediana 1,6 mg / dl), sendo que a presença de hiperbilirrubinemia (> 2 mg / dl) só foi observada em 7 (28%) pacientes durante todo o curso de DVO.
“Se fossem aplicados os critérios de Baltimore, apenas 6 (24%) pacientes com DVO teriam sido identificados, enquanto 16 (65%) seriam diagnosticados pelos critérios de Seattle modificados, com atraso mediano de 3 dias (0-11 dias) na comparação com os critérios EBMT”, compara a análise.
Em síntese, a melhor compreensão da DVO e a disponibilidade de tratamento eficaz impõem a necessidade de novos critérios para diagnosticar DVO em crianças e classificar a gravidade da doença veno-oclusiva hepática na população pediátrica. Novos critérios de classificação reforçam que o diagnóstico oportuno assume importância crítica diante da disponibilidade de opções terapêuticas.
Defibrotida (Defitelio®, Zodiac) – é comercializado como solução para infusão intravenosa, após diluição recomendada. É indicado para o tratamento de pacientes adultos e pediátricos com doença veno-oclusiva hepática (VOD) também conhecida como síndrome da obstrução sinusoidal (SOS), com disfunção renal ou pulmonar após transplante de células-tronco hematopoiéticas (TCTH).
Cada frasco contém 200 mg/2,5 mL (80 mg/mL). Cada cartucho contém 10 frascos de uso único. Apresenta-se como a única medicação indicada para o tratamento da DVO em adultos e crianças
Assista sobre o mesmo assunto:
Neste vídeo, Adriana Seber, onco-hematologista do TMO do Hospital Samaritano, e o radiologista Henrique Lederman, professor emérito Departamento de Diagnóstico por Imagem da Escola Paulista de Medicina (UNIFESP), discutem os desafios do diagnóstico e do tratamento da DVO.
Referências:
- Coppell JA, Richardson PG, Soiffer R, et al. Hepatic veno-occlusive disease following stem cell transplantation: incidence, clinical course, and outcome., Biol Blood Marrow Transplant, 2010, vol. 16 2(pg. 157-168)
- Richardson PG, Riches ML, Kernan NA, et al. Phase 3 trial of defibrotide for the treatment of severe veno-occlusive disease and multi-organ failure., Blood, 2016 127(13):1656-1665
- Richardson PG, Soiffer RJ, Antin JH, et al. Defibrotide for the treatment of severe hepatic veno-occlusive disease and multiorgan failure after stem cell transplantation: a multicenter, randomized, dose-finding trial., Biol Blood Marrow Transplant, 2010, vol. 167(pg. 1005-1017)
- Kernan NA, Grupp S, Smith AR, et al. Final results from a defibrotide treatment-IND study for patients with hepatic veno-occlusive disease/sinusoidal obstruction syndrome. Br J Haematol. 2018;181(6):816-827. doi:10.1111/bjh.15267
- FDA approves first treatment for rare disease in patients who receive stem cell transplant from blood or bone marrow. Available at: https://www.fda.gov/news-events/press-announcements/fda-approves-first-treatment-rare-disease-patients-who-receive-stem-cell-transplant-blood-or-bone; 2016
- https://www.in.gov.br/materia/-/asset_publisher/Kujrw0TZC2Mb/content/id/66389352/do1a-2019-03-11-resolucao-re-n-596-de-7-de-marco-de-2019-66389235
- Santos M de O. Estimativa 2018: Incidência de Câncer no Brasil. Rev. Bras. Cancerol. [Internet]. 30 de março de 2018 [citado 3 de agosto de 2021];64(1):119-20. Disponível em: https://rbc.inca.gov.br/revista/index.php/revista/article/view/115
- https://sbtmo.org.br/userfiles/aulas/arquivo_20171030163215.pdf.
- Mohty M, Malard F, Abecassis M, et al. Revised diagnosis and severity criteria for sinusoidal obstruction syndrome/veno-occlusive disease in adult patients: a new classification from the European Society for Blood and Marrow Transplantation. Bone Marrow Transplant. 2016;51(7):906-912. doi:10.1038/bmt.2016.130
- Corbacioglu, S., Carreras, E., Ansari, M. et al. Diagnosis and severity criteria for sinusoidal obstruction syndrome/veno-occlusive disease in pediatric patients: a new classification from the European society for blood and marrow transplantation. Bone Marrow Transplant 53, 138–145 (2018). https://doi.org/10.1038/bmt.2017.161
- Corbacioglu S, Carreras E, Mohty M, Pagliuca A, Boelens JJ, Damaj G et al. Defibrotide for the treatment of hepatic veno-occlusive disease: final results from the international compassionate-use program. Biol Blood Marrow Transplant 2016; 22: 1874–1882
- Szmit, Z., Gorczynska, E., Król, A. et al. Introduction of new pediatric EBMT criteria for VOD diagnosis: is it time-saving or money-wasting? Bone Marrow Transplant 55, 2138–2146 (2020). https://doi.org/10.1038/s41409-020-0918-1
- Corbacioglu S, Greil J, Peters C, Wulffraat N, Laws HJ, Dilloo D et al. Defibrotide in the treatment of children with veno-occlusive disease (VOD): a retrospective multicentre study demonstrates therapeutic efficacy upon early intervention. Bone Marrow Transplant 2004; 33: 189–195
- Corbacioglu S, Cesaro S, Faraci M, Valteau-Couanet D, Gruhn B, Rovelli A et al. Defibrotide for prophylaxis of hepatic veno-occlusive disease in paediatric haemopoietic stem-cell transplantation: an open-label, phase 3, randomised controlled trial. Lancet 2012; 379: 1301–1309.








