Em 2018, o anti-PD-L1 avelumabe (Bavencio®) se tornou o primeiro tratamento aprovado no Brasil para pacientes com carcinoma de células de Merkel metastático (mMCC), com base nos dados de eficácia e segurança do estudo pivotal de fase II JAVELIN Merkel 200. Agora, follow up1 de mais de 5 anos apresentado no Congresso Anual da Sociedade Americana de Oncologia Clínica (ASCO 2021) confirmou benefício significativo de sobrevida global (SG) nessa população de pacientes, com mediana de 12,6 meses e taxas de SG em 48 e 60 meses de 30% e 26%, respectivamente.
“Esses resultados apoiam ainda mais o papel de avelumabe como tratamento padrão para esses pacientes”, afirmou Paul Nghiem, médico da Universidade de Washington e primeiro autor da análise apresentada no ASCO 2021.
O estudo JAVELIN Merkel 200 (NCT02155647)2, internacional, multicêntrico, aberto, de Fase II, avalia o tratamento com o anticorpo monoclonal avelumabe em duas coortes de pacientes com mMCC como tratamento na progressão da doença após quimioterapia (Parte A); e como monoterapia em primeira linha (Parte B).
Em 2018, o anti-PD-L1 avelumabe (Bavencio®) se tornou o primeiro tratamento aprovado no Brasil para pacientes com carcinoma de células de Merkel metastático (mMCC), com base nos dados de eficácia e segurança do estudo pivotal de fase II JAVELIN Merkel 200. Agora, follow up1 de mais de 5 anos apresentado no Congresso Anual da Sociedade Americana de Oncologia Clínica (ASCO 2021) confirmou benefício significativo de sobrevida global (SG) nessa população de pacientes, com mediana de 12,6 meses e taxas de SG em 48 e 60 meses de 30% e 26%, respectivamente.
“Esses resultados apoiam ainda mais o papel de avelumabe como tratamento padrão para esses pacientes”, afirmou Paul Nghiem, médico da Universidade de Washington e primeiro autor da análise apresentada no ASCO 2021.
O estudo JAVELIN Merkel 200 (NCT02155647)2, internacional, multicêntrico, aberto, de Fase II, avalia o tratamento com o anticorpo monoclonal avelumabe em duas coortes de pacientes com mMCC como tratamento na progressão da doença após quimioterapia (Parte A); e como monoterapia em primeira linha (Parte B).
Para a parte A do estudo, foram elegíveis pacientes (idade ≥ 18 anos) com MCC estadio IV histologicamente confirmado, refratários à quimioterapia, performance status ECOG 0 e 1, doença mensurável por RECIST v.1.1, função hematológica, hepática e renal adequadas e status imunocompetente. A seleção de pacientes não foi baseada na expressão de PD-L1 ou no status de poliomavírus da célula Merkel.
A amostra avaliada envolveu 88 pacientes com mediana de 72,5 anos e bom status de desempenho (55,7% ECOG PS 0 e 44,3% ECOG PS 1), que receberam uma (59,1%), duas (29,5%), três ou mais (11,4 %) linhas de tratamento prévio. Os participantes foram tratados com avelumabe 10 mg/kg por via intravenosa uma vez a cada duas semanas, até progressão da doença, toxicidade inaceitável ou retirada do consentimento.
O endpoint primário do estudo foi a melhor resposta global de acordo com RECIST v1.1, avaliada por um comitê de revisão independente. Os desfechos secundários incluíram duração da resposta, sobrevida livre de progressão (SLP), sobrevida global (SG), status de resposta por RECIST em 6 e 12 meses, segurança e tolerabilidade, farmacocinética e imunogenicidade de avelumabe.
|
O carcinoma de células de Merkel é um câncer de pele agressivo associado ao poliomavírus de células de Merkel, exposição a irradiação ultravioleta, imunossupressão e envelhecimento.10,11 A idade média dos pacientes é de aproximadamente 75 anos, e 5–12% apresenta doença metastática ao diagnóstico.10,12, 13, 14 Sua incidência é de 0,2–0,4 casos por 100 mil pessoas/ano na Europa, 0,79 casos por 100 mil pessoas/ano nos Estados Unidos, e 1,6 casos por 100 mil pessoas/ano na Austrália.12, 15, 16 A incidência global e a mortalidade por carcinoma de células de Merkel aumentaram substancialmente nos últimos 30 anos.12, 15 No Brasil, dados coletados dos Registros de Câncer de Base Populacional (2000 a 2015) e dos Registros de Câncer de Base Hospitalar (2000 e 2017) demonstraram que as taxas médias de incidência padronizadas por idade aumentaram significativamente em homens entre 2000 (0,31 / 1.000.000) e 2015 (1,21 / 1.000.000), com uma variação percentual anual de 9,4 (95% CI: 4,7–14,4; p <0,001). Nas mulheres, as taxas de incidência se mantiveram estáveis no período, com uma variação percentual anual de 3,1 (95% CI: 0,0–6,2; p <0,10).17 Embora seja considerado quimiossensível, o benefício de sobrevida é limitado com quimioterapia, com taxas de sobrevida global em cinco anos que variam entre 0% e 18% para pacientes com doença metastática18, o que evidencia ainda mais a quebra de paradigma proporcionada pelo avelumabe no tratamento dessa população de pacientes. |
Resultados
Os resultados reportados no ASCO 2021 em um follow up superior a 5 anos mostram que no grupo tratado com avelumabe após o tratamento de primeira linha com quimioterapia, o ganho de sobrevida global atingiu a mediana de 12,6 meses (95% CI, 7,5-17,1 meses), com taxas de sobrevida global em 48 e 60 meses de 30% (95% CI, 20%-40%) e 26% (95% CI, 17%-36%), respectivamente.
Os pacientes com tumores PD-L1 positivo tiveram uma sobrevida global superior em comparação com pacientes PD-L1 negativo, com mediana de SG de 12,9 meses no subgrupo PD-L1 positivo versus 7,3 meses no subgrupo PD-L1 negativo, e taxas de SG em cinco anos de 28% e 19%, respectivamente. “Embora tenha sido observada sobrevida global superior em pacientes com expressão de PD-L1, as respostas foram relatadas em todos os pacientes, independentemente do status de PD-L1, e o benefício de sobrevida global em ambos os subgrupos excede em muito os resultados observados em análise retrospectiva de quimioterapia na segunda linha ou posterior”, observam os autores.
No cut off de dados (25 de setembro de 2020), o tratamento estava em andamento em 1 paciente (1,1%) e um paciente adicional (1,1%) havia reiniciado avelumabe após a descontinuação anterior do tratamento. As razões para a descontinuação do tratamento foram progressão da doença (n = 45 [51,1%]), evento adverso (AE; n = 11 [12,5%]), morte (n = 10 [11,4%]), retirada do consentimento (n = 9 [10,2%]), perda de seguimento (n = 1 [1,1%]), não cumprimento do protocolo (n = 1 [1,1%]) e outro motivo (n = 10 [11,4%]).
Dezenove pacientes (21,6%) interromperam o tratamento, mas permaneceram em acompanhamento, e 63 pacientes (71,6%) morreram; as causas de morte foram progressão da doença (n = 49 [55,7%]), motivo desconhecido (n = 9 [10,2%]), eventos adversos não relacionados ao tratamento (n = 3 [3,4%]) e outros motivos (n = 2 [2,3%]).
Nghiem et al. relatam, ainda, que 26 pacientes (29,5%) receberam terapia anticâncer subsequente ao tratamento com avelumabe, especialmente carboplatina e etoposídeo (n = 4 [4,5%]) e pembrolizumabe (n = 4 [4,5%]).
“Este é o acompanhamento mais longo já relatado para uma coorte de pacientes com carcinoma de células de Merkel metastático tratados com inibidor de checkpoint imune, demonstrando que a monoterapia com avelumabe levou a uma sobrevida global significativa a longo prazo em pacientes cuja doença progrediu após a quimioterapia”, destacam.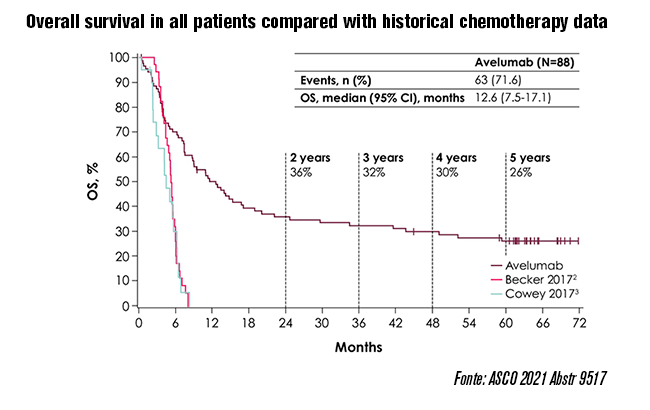
Eficácia e Segurança
Os primeiros dados de eficácia e seguranças apresentados no ASCO 20163 e posteriormente publicados por Kaufman et al no Lancet Oncology4 mostraram uma taxa de resposta objetiva (ORR) de 31,8% (28 de 88 pacientes; 95,9% CI: 21,9 – 43,1%). A duração da resposta foi de 2,8 - 14,6+mos (mediana não alcançada), com 14 de 18 respostas ocorrendo na semana 7. “Avelumabe foi bem tolerado, com poucos eventos adversos de grau 3 relacionados ao tratamento, sem eventos adversos de grau 4 ou mortes”, observaram os autores.
Os resultados basearam a aprovação acelerada para o tratamento de pacientes com mMCC pelas principais agências regulatórias mundiais, como U.S Food and Drug Administration5 e European Medicines Agency (EMA)6. No Brasil, o medicamento também é aprovado pela Agência Nacional de Vigilância Sanitária (Anvisa) como monoterapia para o tratamento do carcinoma de células de Merkel metastático, tanto em primeira linha como em linhas subsequentes7, administrado em dose fixa de 800 mg por infusão intravenosa durante 60 minutos a cada 2 semanas até a progressão da doença ou toxicidade inaceitável.8
No ASCO 2018, atualização de dados com seguimento de dois anos do JAVELIN Merkel 200 demonstrou que a taxa de resposta objetiva (ORR) confirmada de 33,0% (95% CI 23,3-43,8; resposta completa em 11,4%) permaneceu inalterada em relação às análises anteriores de 1 ano e 18 meses; as respostas estavam em andamento em 19 de 29 pacientes, incluindo 12 pacientes com duração de resposta superior a 2 anos.9
Referências:
1 - Avelumab in patients with previously treated Merkel cell carcinoma (JAVELIN Merkel 200): Updated overall survival data after more than five years of follow up. – Paul Nghiem et al - DOI: 10.1200/JCO.2021.39.15_suppl.9517 Journal of Clinical Oncology 39, no. 15_suppl (May 20, 2021) 9517-9517. - Published online May 28, 2021.
https://ascopubs.org/doi/abs/10.1200/JCO.2021.39.15_suppl.9517
2 - Avelumab in Participants With Merkel Cell Carcinoma (JAVELIN Merkel 200) - ClinicalTrials.gov Identifier: NCT02155647
https://clinicaltrials.gov/ct2/show/NCT02155647
3 - Avelumab (MSB0010718C; anti-PD-L1) in patients with metastatic Merkel cell carcinoma previously treated with chemotherapy: Results of the phase 2 JAVELIN Merkel 200 trial. – Howard Kaufman; Paul Nghiem et al - DOI: 10.1200/JCO.2016.34.15_suppl.9508 Journal of Clinical Oncology 34, no. 15_suppl (May 20, 2016) 9508-9508. - Published online May 20, 2016.
https://ascopubs.org/doi/10.1200/JCO.2016.34.15_suppl.9508
4 - Avelumab in patients with chemotherapy-refractory metastatic Merkel cell carcinoma: a multicentre, single-group, open-label, phase 2 trial – Howard Kaufman, MD; Sandra P D’Angelo et al - Published:September 01, 2016 DOI:https://doi.org/10.1016/S1470-2045(16)30364-3
https://www.thelancet.com/journals/lanonc/article/PIIS1470-2045(16)30364-3/fulltext
5 - FDA approves first treatment for rare form of skin câncer -
https://www.fda.gov/news-events/press-announcements/fda-approves-first-treatment-rare-form-skin-cancer
6 – BAVENCIO – European Medicines Agency -
https://www.ema.europa.eu/en/medicines/human/EPAR/bavencio
7 - DIÁRIO OFICIAL DA UNIÃO - Publicado em 04/06/2018; Edição: 105; Seção: 1 - Suplemento | Página: 24 – Disponível em
https://www.in.gov.br/web/dou/-/resolucao-re-n-1-367-de-30-de-maio-de-2018-16935376
8 – BAVENCIO (Avelumabe) - Bula para o profissional de saúde
https://www.merckgroup.com/br-pt/bulario/Bavencio_Bula%20Profissional_110820.pdf
9 - Two-year efficacy and safety update from JAVELIN Merkel 200 part A: A registrational study of avelumab in metastatic Merkel cell carcinoma progressed on chemotherapy. – Paul Nghiem et al - DOI: 10.1200/JCO.2018.36.15_suppl.9507 Journal of Clinical Oncology 36, no. 15_suppl (May 20, 2018) 9507-9507. Published online June 01, 2018.
https://ascopubs.org/doi/10.1200/JCO.2018.36.15_suppl.9507
10 - Agelli M, Clegg LX. Epidemiology of primary Merkel cell carcinoma in the United States. J Am Acad Dermatol 2003; 49: 832–41.
11 - Feng H, Shuda M, Chang Y, Moore PS. Clonal integration of a polyomavirus in human Merkel cell carcinoma. Science 2008; 319: 1096–100.
12 - Fitzgerald TL, Dennis S, Kachare SD, Vohra NA, Wong JH, Zervos EE. Dramatic increase in the incidence and mortality from Merkel cell carcinoma in the United States. Am Surg 2015; 81: 802–06.
13 - Allen PJ, Bowne WB, Jaques DP, Brennan MF, Busam K, Coit DG. Merkel cell carcinoma: prognosis and treatment of patients from a single institution. J Clin Oncol 2005; 23: 2300–09.
14 - Lemos BD, Storer BE, Iyer JG, et al. Pathologic nodal evaluation improves prognostic accuracy in Merkel cell carcinoma: analysis of 5823 cases as the basis of the fi rst consensus staging system. J Am Acad Dermatol 2010; 63: 751–761.
15 Lebbé C, Becker JC, Grob JJ, et al. Diagnosis and treatment of Merkel cell carcinoma. European consensus-based interdisciplinary guideline. Eur J Cancer 2015; 51: 2396–403.
16 - Youlden DR, Soyer HP, Youl PH, Fritschi L, Baade PD. Incidence and survival for Merkel cell carcinoma in Queensland, Australia, 1993–2010. JAMA Dermatol 2014; 150: 864–72.
17 - de Melo AC, Santos Thuler LC. Trends in the incidence and morbidity of Merkel cell carcinoma in Brazil. Future Oncol. 2021 May 7. doi: 10.2217/fon-2020-1313. Epub ahead of print. PMID: 33960199.
18 - Terheyden P, Becker JC. New developments in the biology and the treatment of metastatic Merkel cell carcinoma. Curr Opin Oncol. 2017 Mar 9. doi: 10.1097/CCO.0000000000000363 [Epub ahead of print] https://pubmed.ncbi.nlm.nih.gov/28282342/








