Depois da aprovação do anti PD-L1 avelumabe (Bavencio®) em monoterapia para o tratamento de pacientes com carcinoma de células de Merkel metastático, a Agência Nacional de Vigilância Sanitária (Anvisa) ampliou a indicação de avelumabe para o tratamento de pacientes adultos com carcinoma de células renais avançado (RCC), em associação com axitinibe1. A decisão da Anvisa foi anunciada em novembro de 2019 e é baseada nos resultados do JAVELIN RENAL 101, ensaio que demonstrou ganho significativo de sobrevida livre de progressão em pacientes que receberam avelumabe mais axitinibe como tratamento de primeira linha na doença avançada, independentemente da expressão de PD-L1.
Este estudo randomizado internacional de Fase III comparou avelumabe mais axitinibe com o inibidor de tirosina-quinase sunitinibe em pacientes com RCC avançado sem tratamento sistêmico prévio. Os resultados da análise interina foram reportados no New England Journal of Medicine, em artigo de Motzer et al.2, e mostram que avelumabe reduziu em 39% o risco de progressão ou morte em pacientes com PD-L1 ≥ 1% (HR 0,61; P <0,001). A combinação com avelumabe também prolongou em mais de 5 meses a mediana de SLP na população geral, independentemente do status de PD-L1 (HR: 0,69; p<0,001), assim como duplicou a taxa de resposta.
“A maioria dos pacientes com diagnóstico de carcinoma renal tem componentes de células claras e apresenta anormalidades genéticas que levam à produção excessiva do fator de crescimento endotelial vascular (VEGF), fator-chave para a angiogênese”, descreve a publicação na NEJM. No entanto, Motzer et al. destacam que embora o TKI VEGFR sunitinibe seja um padrão de terapia de primeira linha para RCC avançado, muitos pacientes têm resistência ao uso de antiangiogênicos e progridem ao tratamento com esses medicamentos.
Depois da aprovação do anti PD-L1 avelumabe (Bavencio®) em monoterapia para o tratamento de pacientes com carcinoma de células de Merkel metastático, a Agência Nacional de Vigilância Sanitária (Anvisa) ampliou a indicação de avelumabe para o tratamento de pacientes adultos com carcinoma de células renais avançado (RCC), em associação com axitinibe1. A decisão da Anvisa foi anunciada em novembro de 2019 e é baseada nos resultados do JAVELIN RENAL 101, ensaio que demonstrou ganho significativo de sobrevida livre de progressão em pacientes que receberam avelumabe mais axitinibe como tratamento de primeira linha na doença avançada, independentemente da expressão de PD-L1.
Este estudo randomizado internacional de Fase III comparou avelumabe mais axitinibe com o inibidor de tirosina-quinase sunitinibe em pacientes com RCC avançado sem tratamento sistêmico prévio. Os resultados da análise interina foram reportados no New England Journal of Medicine, em artigo de Motzer et al.2, e mostram que avelumabe reduziu em 39% o risco de progressão ou morte em pacientes com PD-L1 ≥ 1% (HR 0,61; P <0,001). A combinação com avelumabe também prolongou em mais de 5 meses a mediana de SLP na população geral, independentemente do status de PD-L1 (HR: 0,69; p<0,001), assim como duplicou a taxa de resposta.
“A maioria dos pacientes com diagnóstico de carcinoma renal tem componentes de células claras e apresenta anormalidades genéticas que levam à produção excessiva do fator de crescimento endotelial vascular (VEGF), fator-chave para a angiogênese”, descreve a publicação na NEJM. No entanto, Motzer et al. destacam que embora o TKI VEGFR sunitinibe seja um padrão de terapia de primeira linha para RCC avançado, muitos pacientes têm resistência ao uso de antiangiogênicos e progridem ao tratamento com esses medicamentos.
Foi exatamente essa necessidade médica não atendida que motivou o ensaio clínico com avelumabe nessa população de pacientes. O novo agente é um inibidor de checkpoint imune que bloqueia o anticorpo do ligante da proteína de morte celular programada 1 (PD-L1), mecanismo que já demonstrou atividade antitumoral em diferentes plataformas de tratamento.
Eficácia e segurança
Para avaliar a eficácia e segurança do anti PD-L1 avelumabe no carcinoma renal, o ensaio JAVELIN RENAL 101 considerou pacientes com RCC de células claras avançado com pelo menos uma lesão mensurável (RECIST, versão 1.1), bom performance- status (ECOG 0-1) e qualquer risco prognóstico, de acordo com os critérios do Memorial Sloan Kettering Cancer Center (MSKCC) e do International Metastatic Renal Cell Carcinoma Database Consortium (IMDC).
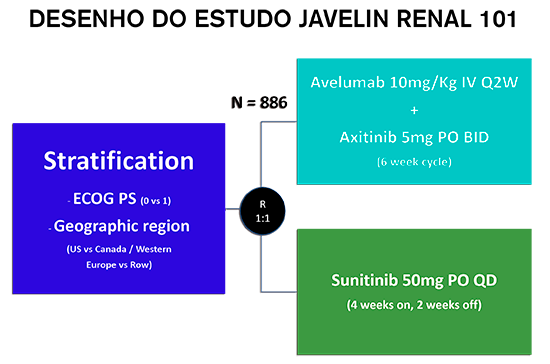
Os pacientes elegíveis foram randomizados (1: 1) para receber avelumabe (10 mg por quilograma de peso corporal) por via intravenosa a cada 2 semanas mais axitinibe (5 mg) por via oral duas vezes ao dia ou sunitinibe (50 mg) por via oral uma vez ao dia por 4 semanas (6 ciclos). Os principais endpoints primários foram sobrevida livre de progressão (SLP) e sobrevida global (SG) entre os pacientes com expressão de PD-L1 tumoral ≥ 1%. Endpoints secundários incluíram sobrevida livre de progressão na população geral, resposta objetiva e dados de segurança.
Nesta análise, 886 pacientes cumpriram os critérios de inclusão e foram randomizados para receber avelumabe mais axitinibe (N= 442) ou sunitinibe (N= 444). Entre os 560 pacientes com tumores PD-L1-positivo (63,2%), a SLP mediana foi de 13,8 meses com avelumabe mais axitinibe, em comparação com 7,2 meses com sunitinibe (HR 0,61; IC de 95%, 0,47 a 0,79; P <0,001). Na população geral, a sobrevida livre de progressão mediana foi de 13,8 meses no braço de combinação versus 8,4 meses com sunitinibe (HR: 0,69; IC de 95%, 0,56 a 0,84; P <0,001).
A taxa de resposta também mostrou a vantagem da combinação com imunoterapia. A taxa de resposta objetiva foi o dobro entre pacientes tratados com avelumabe e axitinibe, tanto entre aqueles PD-L1 positivos (55, 2 versus 25,5%) quanto na população geral (51,4% vs. 25,7%). Em cada braço, 4,4% e 2,1% dos pacientes alcançaram resposta patológica completa. O benefício se manteve em todos os subgrupos, independentemente da expressão de PD-L1 e do risco prognóstico. Para pacientes de risco favorável, intermediário e baixo no escore IMDC, a taxa de resposta objetiva foi respectivamente de 68,1%, 51,3% e 30,6% entre aqueles tratados com avelumabe mais axitinibe, em comparação com 37,5%, 25,4% e 11,3% dos pacientes que receberam sunitinibe.
Em relação ao perfil de segurança, eventos adversos (EAs) ocorreram em 99,5% dos pacientes no grupo de avelumabe mais axitinibe e em 99,3% dos pacientes no grupo de sunitinibe; EAs de grau 3 ou superior foram reportados em 71,2% e em 71,5% dos pacientes de cada grupo, respectivamente. A frequência e severidade dos eventos adversos foi consistente com dados já conhecidos dos dois agentes, tanto em monoterapia, quanto em esquemas de combinação.
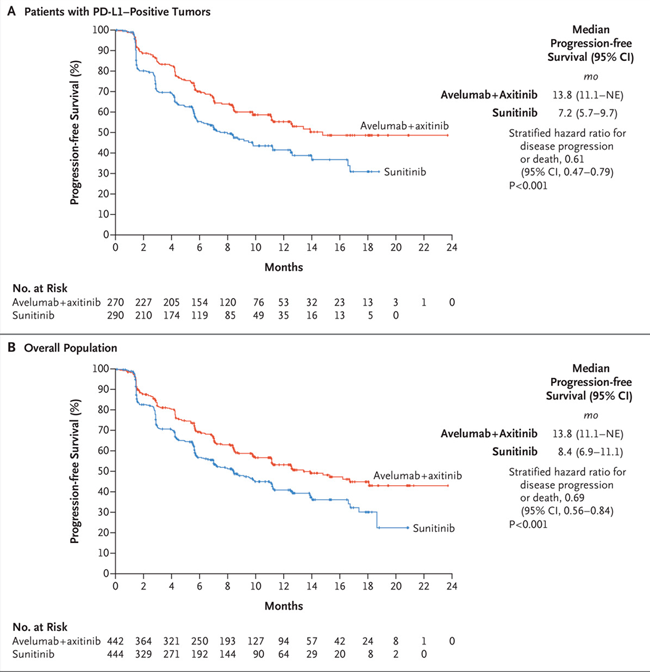
Fonte dos gráficos: (2) New England Journal of Medicine, 380(12), 1103-1115
Em atualização publicada em 2020 por T. K. Choueiri et al., o ensaio JAVELIN RENAL 101 mostrou dados da segunda análise interina3. No corte de dados, em 28 de janeiro de 2019, um total de 242 pacientes (54,8%) havia interrompido o tratamento com avelumabe + axitinibe e 336 pacientes (75,7%) haviam interrompido o uso de sunitinibe. Os resultados na população geral foram consistentes com os da população PD-L1 ≥ 1%, confirmando a SLP significativamente superior no braço de combinação versus o braço de sunitinibe (HR 0,69; P <0,0001).
Em conclusão, a combinação de avelumabe mais axitinibe mostrou benefício significativo de SLP em pacientes com carcinoma de células renais avançado. Dados de sobrevida global ainda estão imaturos.
O carcinoma de células renais constitui cerca de 3% de todos os tumores malignos em adultos. Estimativas do GLOBOCAN 2018 apontam 403.262 novos casos de câncer renal a cada ano e indicam que a incidência cresce nos países desenvolvidos e em desenvolvimento.
No tratamento do câncer renal avançado, a dose recomendada de avelumabe é de 800 mg (4 ampolas), administrada por infusão intravenosa ao longo de 60 minutos, a cada 2 semanas, independentemente do peso do paciente1.
O estudo JAVELIN RENAL 101 está registrado na plataforma ClinicalTrials.gov: NCT02684006
Referências:
- DOU – Diário Oficial da União ISSN 1677-7042 Nº 147, segunda-feira, 3 de agosto de 2020. 2. BAVENCIO® (avelumabe) bula ANVISA 11/08/2020. ANVISA – Informações técnicas de indicação do Bavencio (Avelumabe) para RCC
- Motzer, R. J., Penkov, K., Haanen, J., Rini, B., Albiges, L., Campbell, M. T., ... & Lee, J. L. (2019). Avelumab plus axitinib versus sunitinib for advanced renal-cell carcinoma. New England Journal of Medicine, 380(12), 1103-1115
- Choueiri, T. K., Motzer, R. J., Rini, B. I., Haanen, J., Campbell, M. T., Venugopal, B., … Albiges, L. (2020). Updated efficacy results from the JAVELIN Renal 101 trial: first-line avelumab plus axitinib versus sunitinib in patients with advanced renal cell carcinoma. Annals of Oncology. doi:10.1016/j.annonc.2020.04.010








