Depois de trinta anos sem praticamente nenhum progresso, o tratamento do carcinoma urotelial avançado ou metastático vive mudanças sem precedentes, reconfigurando o cenário para médicos e pacientes. Como estratégia de manutenção na primeira linha de tratamento da doença irressecável localmente avançada ou metastática, a imunoterapia com avelumabe (Bavencio®) aumentou significativamente a sobrevida global, com 21,4 meses versus 14,3 meses, reduzindo em 31% o risco de morte. Os dados são do estudo randomizado de fase III JAVELIN Bladder 100 (NCT02603432)1, que demonstrou o maior benefício de sobrevida global observado até o momento no câncer urotelial localmente avançado ou metastático, com resultados que embasaram a aprovação das principais agências reguladoras mundiais2, entre elas a da Agência Nacional de Vigilância Sanitária (ANVISA), conforme publicado no Diário Oficial da União no dia 28 de dezembro de 20203.
“JAVELIN Bladder 100 alcançou seu principal endpoint, demonstrando sobrevida global prolongada com avelumabe como manutenção de primeira linha em pacientes com carcinoma urotelial avançado ou metastático. Os benefícios foram observados em todos os pacientes, independentemente da expressão de PD-L1”, descreveram Powles, T et al. em artigo na New England Journal of Medicine4.
Depois de trinta anos sem praticamente nenhum progresso, o tratamento do carcinoma urotelial avançado ou metastático vive mudanças sem precedentes, reconfigurando o cenário para médicos e pacientes. Como estratégia de manutenção na primeira linha de tratamento da doença irressecável localmente avançada ou metastática, a imunoterapia com avelumabe (Bavencio®) aumentou significativamente a sobrevida global, com 21,4 meses versus 14,3 meses, reduzindo em 31% o risco de morte. Os dados são do estudo randomizado de fase III JAVELIN Bladder 100 (NCT02603432)1, que demonstrou o maior benefício de sobrevida global observado até o momento no câncer urotelial localmente avançado ou metastático, com resultados que embasaram a aprovação das principais agências reguladoras mundiais2, entre elas a da Agência Nacional de Vigilância Sanitária (ANVISA), conforme publicado no Diário Oficial da União no dia 28 de dezembro de 20203.
“JAVELIN Bladder 100 alcançou seu principal endpoint, demonstrando sobrevida global prolongada com avelumabe como manutenção de primeira linha em pacientes com carcinoma urotelial avançado ou metastático. Os benefícios foram observados em todos os pacientes, independentemente da expressão de PD-L1”, descreveram Powles, T et al. em artigo na New England Journal of Medicine4.
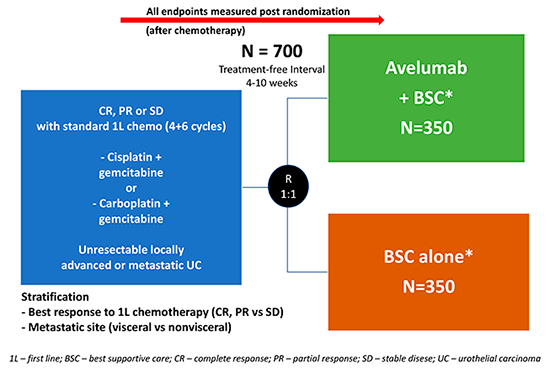
Neste estudo, indicado como primeiro Late Breaking Abstract do ASCO 2020 Virtual Meeting5, pacientes com carcinoma urotelial localmente avançado ou metastático que não progrediram após quimioterapia de 1ª linha foram randomizados (1:1) para receber avelumabe + BSC (melhor cuidado de suporte) ou BSC isolado. Foram elegíveis pacientes que receberam a quimioterapia de indução baseada em platina (cisplatina ou carboplatina) em combinação com gemcitabina e doença estável após 4-6 ciclos de tratamento. O endpoint primário foi sobrevida global (SG), avaliada em 2 populações: em todos os pacientes randomizados e naqueles com tumores PD-L1+ (Ventana Ensaio SP263). Endpoints secundários incluíram sobrevida livre de progressão (SLP), resposta objetiva e dados de segurança (Figura 1).
Figura 1 – Desenho do estudo JAVELIN Bladder 100
Resultados
Entre 11 de maio de 2016 e 4 de junho de 2019, um total de 700 pacientes foram inscritos em 197 centros, em 29 países, randomizados para receber tratamento de manutenção com avelumabe + BSC (N = 350) ou BSC isoladamente (N = 350), acompanhados por uma mediana de 19,6 e 19,2 meses, respectivamente. No geral, 358 (51%) pacientes tinham tumores PD-L1+.
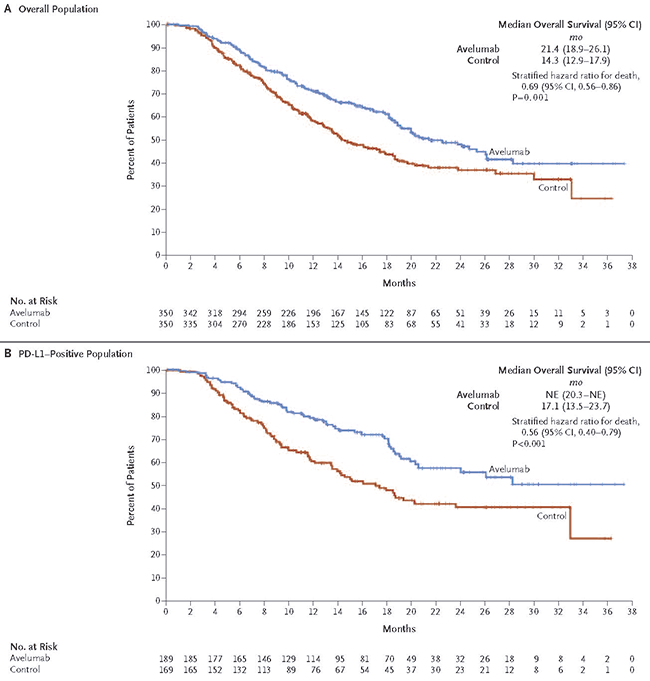
A análise primária mostra que a combinação de avelumabe + BSC prolongou significativamente a sobrevida global em todos os pacientes randomizados ([HR] 0,69; CI 95% 0,56, 0,86; p = 0,001), com 21,4 meses versus 14,3 meses. Em um ano, 71,3% dos pacientes tratados com avelumabe estavam vivos (95% CI, 66,0% a 76,0%) versus 58,4% (95% CI, 52,7% a 63,7%) dos pacientes do grupo-controle. Os resultados suportam o uso de avelumabe como tratamento de manutenção após quimioterapia, com ganho mediano de sobrevida global de 7,1 meses em relação ao melhor cuidado de suporte. Em pacientes com tumores PD-L1+ (51,1%), avelumabe mostrou ganho de SG ainda maior (HR 0,56; IC95% 0,40, 0,79; p = 0,001). Em um ano, 79,1% dos pacientes PD-L1+ tratados com avelumabe estavam vivos (95% CI, 72,1% a 84,5%) vs 60,4% (95% CI, 52,0% a 67,7%) no grupo BSC.
Figura 2 – Sobrevida Global na População Geral e na População PDL1+
Os principais endpoints secundários também mostraram benefício com o tratamento de manutenção. A sobrevida livre de progressão foi maior no grupo tratado com avelumabe, tanto na população geral, com mediana de 3,7 meses vs 2,0 meses (HR: 0,62; 95% CI, 0,52–0,75), quanto na população PD-L1-positiva, com SLP mediana de 5,7 meses vs 2,1 meses (HR: 0,56; 95% CI, 0,43–0,73). Em pacientes com tumores PD-L1 negativos, a SLP mediana foi de 3,0 meses vs 1,9 meses, novamente com benefício de avelumabe (HR: 0,63; 95% CI, 0,47 - 0,85) em relação ao grupo-controle.
Em relação ao perfil de segurança, eventos adversos (EA) de qualquer grau foram relatados em 98% dos pacientes do braço tratado com avelumabe + BSC e em 77,7% dos pacientes que receberam BSC. Eventos adversos de grau ≥3 ocorreram em 47,4% vs 25,2%, respectivamente. Os EA mais frequentes de grau ≥3 foram infecção no trato urinário (4,4% vs 2,6%), anemia (3,8% vs 2,9%), hematúria (1,7% vs 1,4%), fadiga (1,7% vs 0,6%) e dor nas costas (1,2% vs 2,3%). No grupo que recebeu avelumabe + BSC a taxa de descontinuação do tratamento devido eventos adversos foi de 11,9%.
Análise de Subgrupos
Análises reportadas no ESMO Virtual Congress 20206 mostraram que o benefício de sobrevida global e sobrevida livre de progressão da terapia de manutenção com avelumabe é independente do tipo de resposta à quimioterapia de 1L (SG: HR 0,81 para resposta completa/CR; HR 0,62 para parcial/RP; HR 0,70 para doença estável/DE; SLP: HR 0,65 para CR; HR 0,58 para RP; HR 0,61 para DE) e do tipo de platina utilizada (SG: HR 0,69 para cisplatina + gemcitabina; HR 0,66 para carboplatina + gemcitabina/SLP: HR 0,63 para cisplatina + gemcitabina; HR 0,59 para carboplatina + gemcitabina). Além disso, o benefício clínico conferido por avelumabe como terapia de manutenção na primeira linha não impactou a qualidade de vida dos pacientes com carcinoma urotelial localmente avançado ou metastático.
Avelumabe é um inibidor de checkpoint imune que bloqueia a proteína PD-L1 na superfície das células tumorais. https://clinicaltrials.gov/ct2/show/NCT02603432
Veja mais sobre o estudo JAVELIN Bladder 100
Vídeo exclusivo - Thomas Powles, diretor do Barts Cancer Centre, em Londres, Inglaterra, foi o convidado do Diálogo de Experts, do Onconews, durante o ESMO Virtual Congress 2020, com a participação de Denis Jardim, coordenador de Pesquisa Clínica do Hospital Sírio-Libanês, em São Paulo.
Referências:
1. A Study Of Avelumab In Patients With Locally Advanced Or Metastatic Urothelial Cancer (JAVELIN Bladder 100) – Disponível em https://clinicaltrials.gov/ct2/show/NCT02603432
2. FDA approves avelumab for urothelial carcinoma maintenance treatment - disponível em https://www.fda.gov/drugs/drug-approvals-and-databases/fda-approves-avelumab-urothelial-carcinoma-maintenance-treatment
3. Diário Oficial da União - RESOLUÇÃO-RE Nº 5.368, DE 23 DE DEZEMBRO DE 2020 - Publicado em 28 de dezembro de 2020, Edição 247, Seção 1; Páginas 489-490 https://www.in.gov.br/en/web/dou/-/resolucao-re-n-5.368-de-23-de-dezembro-de-2020-296447208
4. Powles T, Park SH, Voog E, et al. Avelumab maintenance therapy for advanced or metastatic urothelial carcinoma. N Engl J Med 2020;383:1218–30.
5. DOI: 10.1200/JCO.2020.38.18_suppl.LBA1 Journal of Clinical Oncology 38, no. 18_suppl
6. (Presentation #704MO), Presentation #6990 e Presentation #745P








