O papel da radioterapia na doença localizada ou no tumor de próstata localmente avançado é tema de artigo exclusivo do radio-oncologista Rodrigo de Morais Hanriot (foto), coordenador do serviço de radioterapia do Hospital Alemão Oswaldo Cruz. “Não somente o tipo de técnica pode fazer a diferença, mas também o regime de tratamento escolhido, como o hipofracionamento”, afirma o especialista.
O papel da radioterapia na doença localizada ou no tumor de próstata localmente avançado é tema de artigo exclusivo do radio-oncologista Rodrigo de Morais Hanriot (foto), coordenador do serviço de radioterapia do Hospital Alemão Oswaldo Cruz. “Não somente o tipo de técnica pode fazer a diferença, mas também o regime de tratamento escolhido, como o hipofracionamento”, afirma o especialista.
{jathumbnail off}Por Rodrigo de Morais Hanriot*
 O câncer de próstata representa a neoplasia mais frequente entre homens, após o câncer de pele, e nos Estados Unidos para 2015 tem incidência estimada de 220.800 novos casos com 27.540 mortes (para cada 8 novos casos, uma morte). No Brasil os dados oficiais (INCA – MS) apontam para 68.800 novos casos em 2014 com 13.772 mortes (para cada 5 casos, uma morte).
O câncer de próstata representa a neoplasia mais frequente entre homens, após o câncer de pele, e nos Estados Unidos para 2015 tem incidência estimada de 220.800 novos casos com 27.540 mortes (para cada 8 novos casos, uma morte). No Brasil os dados oficiais (INCA – MS) apontam para 68.800 novos casos em 2014 com 13.772 mortes (para cada 5 casos, uma morte).
Mesmo no Brasil estima-se que cerca de 70% dos diagnósticos sejam de estádios I e II, potencialmente curáveis. Deste total, cerca de 15% compreendem doenças localizadas, de baixo risco e potencialmente conduzidas com vigilância ativa, com resultados de longo prazo comparáveis aos de tratamento com intenção radical e sem o risco dos efeitos adversos de cirurgia ou radioterapia, as duas únicas modalidades terapêuticas com potencial curativo demonstrado em longo prazo.
Há muito debate acerca de qual método terapêutico – cirurgia ou radioterapia (seja braquiterapia ou radioterapia externa) – apresenta maior potencial curativo, com divergências não sustentadas entre os especialistas de cada modalidade. Estas divergências são naturais na literatura pois inexistem estudos que comparem diretamente as duas técnicas entre si. Para a cirurgia estes fatores de confusão envolvem destreza individual e volume cirúrgico anual entre os cirurgiões, e entre os radio-oncologistas há diferença entre a técnica disponível para tratamento (radioterapia convencional 2D, radioterapia conformada tridimensional – RTC-3D – ou as mais novas modalidades, como intensidade modulada do feixe – IMRT – com ou sem IGRT – ou radioterapia guiada por imagem, com elevação progressiva da dose empregada e consequente maior probabilidade curativa) e os recursos empregados para estadiamento e adequada seleção terapêutica. E não somente o tipo de técnica pode fazer diferença mas também o regime de tratamento escolhido, como o hipofracionamento.
Esta (nem tão) nova forma de tratamento se beneficia dos avanços tecnológicos de localização do volume alvo de forma diária – IGRT (do inglês radioterapia guiada por imagem) à sofisticação do IMRT para empregar doses diárias maiores, o que reduz o tempo total de tratamento dos convencionais 38 a 40 dias úteis para 28 dias ou mesmo 20 dias úteis, mantendo os bons resultados de controle dos fracionamentos convencionais, conforme os últimos estudos fase III apresentados no último congresso da Associação Americana de Oncologia Clinica – ASCO – GU.
Em uma pesquisa realizada com 3720 especialistas e publicada na New England Journal of Medicine foi realizada votação para a situação de um homem de 63 anos de idade com uma neoplasia de próstata de baixo risco e qual a conduta que o profissional seguiria, entre vigilância ativa, radioterapia ou cirurgia. Ocorreram claras diferenças de acordo com o continente estudado, com dados equilibrados entre as três alternativas nos Estados Unidos, Europa, Ásia e Austrália e Nova Zelândia. Para o continente Africano e America do Sul, a prostatectomia radical atingiu isoladamente quase a metade das indicações. Figura 1.
No Brasil 47% dos votantes selecionaram a prostatectomia radical, 33% radioterapia e somente 20% vigilância ativa. Figura 2. Na Argentina, em contrapartida, 31% dos votantes selecionaram a prostatectomia radical, 44% a radioterapia e 25% vigilância ativa. Figura 3. Em países como a Dinamarca, por exemplo, esta diferença foi pronunciada em favor da vigilância ativa, com 20% dos votos para prostatectomia, 27% para radioterapia e 53% para vigilância ativa. Figura 4. Isto demonstra que a seleção terapêutica tem fatores locais (culturais, tecnológicos, disponibilidade de equipamentos e recursos, remuneração, etc) que contribuem para a maior popularidade e/ou indicação destes.
O melhor estudo disponível comparativo entre tratamentos foi uma meta-análise publicada pelo Prostate Cancer Results Group que analisou e comparou os dados de mais de 18.000 artigos publicados entre 2000 e 2010, com foco entre as diversas opções terapêuticas disponíveis (prostatectomia radical aberta e robótica, radioterapia com RTC-3D, IMRT, Prótons, Braquiterapia), crioterapia, HiFU e comparação de resultados ponderados entre eles, divididos entre baixo risco, risco intermediário e alto risco.
Para a neoplasia de próstata de baixo risco a braquiterapia foi aparentemente superior à radioterapia externa e cirurgia, com dados consistentes, reprodutíveis e pouco variáveis ao longo dos anos e com seguimento considerado de longo prazo. Figura 5.
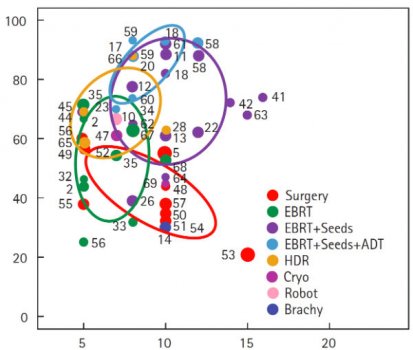
Para a neoplasia de alto risco a associação de braquiterapia com radioterapia externa e hormonioterapia foi superior às terapias isoladas – radioterapia, cirurgia ou braquiterapia – reforçando o conceito de multimodalidade para as neoplasias de alto risco. Figura 6. Nos guidelines do National Comprehensive Cancer Network – NCCN – as neoplasias de próstata de alto risco e muito alto risco (critérios D’Amico) têm o grau de recomendação como Categoria 1 para a radioterapia externa associada a hormonioterapia por 2-3 anos, com prostatectomia radical como Categoria 2A. Neste cenário de alto/muito alto risco a indicação de radioterapia radical associada a hormonioterapia se faz prioritária, reservando a cirurgia como alternativa menos efetiva.
Este conceito de multimodalidade é extensamente estudado na tentativa de se melhorar os resultados terapêuticos das neoplasias de alto risco e/ou localmente avançados. Trial do ECOG para pacientes com neoplasia de próstata de alto risco e/ou localmente avançada foram aleatorizados para somente hormonioterapia ou adição de radioterapia a hormonioterapia. No grupo que recebeu o tratamento combinado houve ganho de sobrevida global, reforçando o papel de tratamento multimodal para neoplasias de alto risco.
Contudo os trials mais reportados são os prospectivos e aleatorizados de radioterapia adjuvante em caso de doença localmente avançada pós-prostatectomia radical (EORTC 22911, SWOG 87-94 e ARO 96-02) que mostraram maior sobrevida livre de recidiva bioquímica, e somente o SWOG 87-94 demonstrando maior sobrevida livre de metástases e sobrevida global. Isto gerou recomendação entre as sociedades americanas de Urologia e Radioterapia (AUA e ASTRO, respectivamente) para somente considerar a radioterapia adjuvante neste cenário, dividindo com os pacientes os riscos e benefícios de seu uso.
Entretanto um novo teste de classificação genomica – Decipherâ– aprovado para uso no sistema de saúde americano Medicare no primeiro semestre de 2015, comprovou que quando estes pacientes se classificam como de alto risco genomico e a radioterapia é realizada somente quando de resgate após falha bioquímica, apresentam 23% de risco de metástases em 5 anos; se a radioterapia é realizada como adjuvante este risco é de somente 6%. Nos grupos de baixo e intermediário riscos não houve diferença entre se irradiar de forma adjuvante ou no resgate.
Este teste é um primeiro passo na direção de se selecionar qual paciente vai se beneficiar de somente uma terapia curativa ou de tratamento multimodal, abrindo espaço para tratamentos personalizados em que se selecionam os melhores recursos a serem empregados, em direção a uma “medicina personalizada”.
Figuras e tabelas
Figura 1. Percentagem dos participantes que selecionou cada uma das opções apresentadas para neoplasia de próstata de baixo risco.
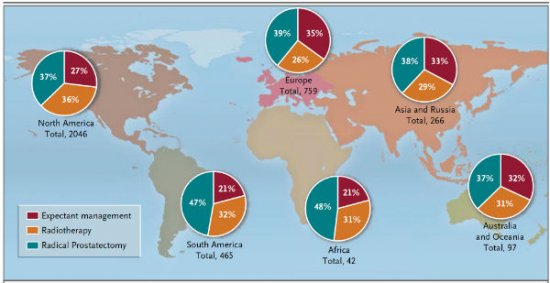
Figura 2. Percentagem de seleção terapêutica dos participantes no Brasil
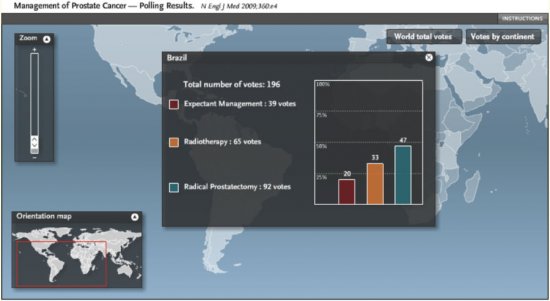
Figura 3. Percentagem de seleção terapêutica dos participantes na Argentina
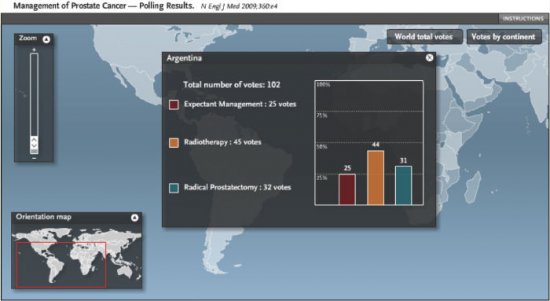
Figura 4. Percentagem de seleção terapêutica dos participantes na Dinamarca
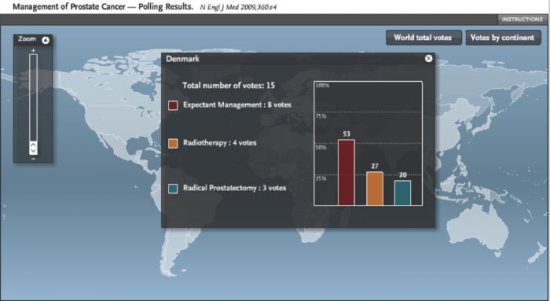
Figura 5. Distribuição da falha bioquímica para neoplasia de próstata de baixo risco.
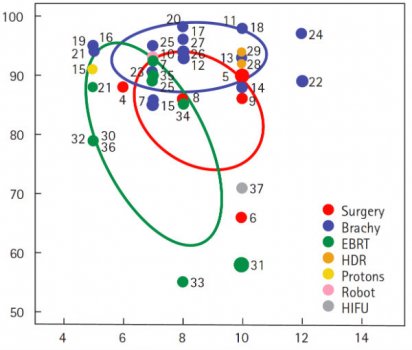
Figura 6. Distribuição da falha bioquímica para neoplasia de próstata de alto risco.
Autor*: Rodrigo de Morais Hanriot*
Radio-oncologista, coordenador do serviço de radioterapia do Hospital Alemão Oswaldo Cruz;
Membro Internacional das Sociedades Americana e Européia de Radioterapia (ASTRO e ESTRO)
Bibliografia
1. Siegel RL, Miller KD, Jemal A. CA: A Cancer Journal for Clinicians 2015;65(1)5-29
2. Zacchi SR, Amorim MHC, Souza MAC, Miotto MHMB, Zandonade E. Associação de variáveis sociodemográficas e clínicas com o estadiamento inicial em homens com câncer de próstata. Cad Saúde Colet 2014;22(1)93-100
3. Robert S. Schwartz. Management of Prostate Cancer — Polling Results.N Engl J Med 2009;360:e4
4. Grimm P, Billiet I, Bostwick Det al. Comparative analysis of prostate-specific antigen free survival outcomes for patients with low, intermediate and high risk prostate cancer treatment by radical therapy. Results from the Prostate Cancer Results Study Group. BJU Int 2012;109(Suppl 1)22-9
5. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelinesâ) version 1.2015. Acessado http://www.nccn.org em 10/2015
6. Bolla M1, van Poppel H, Tombal Bet al. Postoperative radiotherapy after radical prostatectomy for high-risk prostate cancer: long-term results of a randomised controlled trial (EORTC trial 22911). Lancet 2012;380(9858)2018-27
7. Warde P, Mason M, Ding K et al. Combined androgen deprivation therapy and radiation therapy for locally advanced prostate cancer: a randomised, phase 3 trial. Lancet 2011;378(9809)2104–11
8. Thompson IM, Tangen CM, Paradelo Jet al. Adjuvant radiotherapy for pathological T3N0M0 prostate cancer significantly reduces risk of metastases and improves survival: long-term followup of a randomized clinical trial. J Urol 2009;181(3)956-62
9. Wiegel T, Bottke D, Steiner Uet al. Phase III postoperative adjuvant radiotherapy after radical prostatectomy compared with radical prostatectomy alone in pT3 prostate cancer with postoperative undetectable prostate-specific antigen: ARO 96-02/AUO AP 09/95. J Clin Oncol 2009;27(18)2924-30
10. Den RB, Yousefi K, Trabulsi EJ et al.Genomic Classifier Identifies Men With Adverse Pathology After Radical Prostatectomy Who Benefit From Adjuvant Radiation Therapy.J Clin Oncol 2015;33(8)944-51








