Bottom Line:
O conceito de que a disseminação do câncer de mama à distância se dá por via linfática e hematogênica14 está entre os principais motivos que impulsionaram a cirurgia conservadora, levando o tratamento cirúrgico a diminuir sua radicalidade ao longo dos anos. A cirurgia está indicada como terapia primária nas pacientes com doença inicial, mas novas evidências tornam o tratamento cada vez mais personalizado e com avaliação multidisciplinar. Além dos tipos tumorais e estádios clínicos, a decisão clínica deve considerar a idade das pacientes, comorbidades, suas expectativas e desejos.
 Fábio Bagnoli é Professor Instrutor da Faculdade de Ciências Médicas da Santa Casa de São Paulo; Assistente do Setor de Mastologia da Santa Casa de São Paulo; Corresponsável pelo Ambulatório de Quimioterapia Mama da Santa Casa de São Paulo; Responsável pela Reconstrução Mamária da Equipe de Mastologia do Hospital Paulistano (Américas Serviços Médicos); e Membro Titular da Sociedade Brasileira de Mastologia (SBM)
Fábio Bagnoli é Professor Instrutor da Faculdade de Ciências Médicas da Santa Casa de São Paulo; Assistente do Setor de Mastologia da Santa Casa de São Paulo; Corresponsável pelo Ambulatório de Quimioterapia Mama da Santa Casa de São Paulo; Responsável pela Reconstrução Mamária da Equipe de Mastologia do Hospital Paulistano (Américas Serviços Médicos); e Membro Titular da Sociedade Brasileira de Mastologia (SBM)
Resumo
O tratamento do câncer de mama evoluiu muito ao longo dos anos, tanto a abordagem local como a sistêmica. A mastectomia radical à Halsted deu espaço às mastectomias modificadas, cirurgias conservadoras associadas à reconstrução e reparação mamária. A terapia sistêmica neo ou adjuvante, se por um lado ganhou novas drogas com impacto diretamente na sobrevida das pacientes, por outro avalia-se em determinadas situações o descalonamento de drogas. O tratamento da paciente com câncer de mama deve ser personalizado e avaliado multidisciplinarmente, sendo assim a cirurgia está indicada como terapia primária nas pacientes com câncer de mama inicial, já a terapia sistêmica neoadjuvante é a terapia up front nos tumores triplo negativos e HER2+: cT≥2cm ou cN≥1 e nos tumores luminais quando a axila é comprometida e objetiva-se o downstaging axilar.
Tratamento cirúrgico
A cirurgia mamária, mais especificamente a mastectomia radical descrita por Halsted em 1894, foi o tratamento empregado para o câncer de mama independente do estádio clínico por muitos anos, pois acreditava-se que quanto mais radical o procedimento, melhor seria a evolução das pacientes quando submetidas a essa técnica cirúrgica, uma vez que o conceito que vigorava era da disseminação local do tumor1. Realmente foi um grande avanço uma vez que o emprego da mastectomia radical reduziu a mortalidade pelo câncer de mama em cerca de 20% e ao redor de 50% quando realizada em pacientes com tumores iniciais2.
Anos mais tarde a mastectomia radical deu espaço às mastectomias radicais modificadas. Em 1948, Patey e Dyson descrevem a mastectomia radical modificada com preservação do músculo peitoral maior e sequencialmente Auchincloss (1963) e Madden (1965) descrevem a mastectomia com preservação de ambos os músculos peitorais 3,4,5. Com o passar dos anos surgem as mastectomias poupadoras de pele e, posteriormente, de complexo areolopapilar, hoje realizada em pacientes que têm critérios clínicos-oncológicos com indicação para mastectomia 6,7.
Na década de 80, outra quebra de paradigma ocorreu com as publicações dos estudos de Milão, conduzido por Umberto Veronesi, e NSABP B-06 nos Estados Unidos, conduzido por Bernard Fisher. Com mais de 20 anos de seguimento, esses estudos demostraram a segurança oncológica da cirurgia conservadora seguida de radioterapia frente à mastectomia, garantindo também ganhos psicossociais às pacientes8,9 – FIGURAS 1 e 2.
A reconstrução mamária imediata, seja com retalhos mio cutâneos, seja com implantes, passou a ser rotina do tratamento cirúrgico do câncer de mama e não havendo contra indicações deve ser ofertada às pacientes pelos inúmeros ganhos que apresentam, entre eles a boa impressão pelas pacientes sobre a imagem corporal10,11 – FIGURA 3. Da mesma forma, a oncoplastia, associação de cirurgia oncológica com técnicas de cirurgia plástica, passou a ser utilizada quando há riscos de resultados cosméticos não satisfatórios após o tratamento oncológico. Com a combinação das técnicas, é possível preservar mais mamas, uma vez que há possibilidade de realizar cirurgia conservadora em tumores de maiores dimensões. A preservação das mamas impacta positivamente na recuperação da paciente, aderência ao tratamento, autoestima, bem-estar psicossocial, retorno mais precoce às atividades laborais e impacto positivo no relacionamento afetivo e conjugal12,13 – TABELA 1.
O conceito de que a disseminação do câncer de mama à distância se dá por via linfática e hematogênica14 está entre os principais motivos que impulsionaram a cirurgia conservadora, levando o tratamento cirúrgico a diminuir sua radicalidade ao longo dos anos. 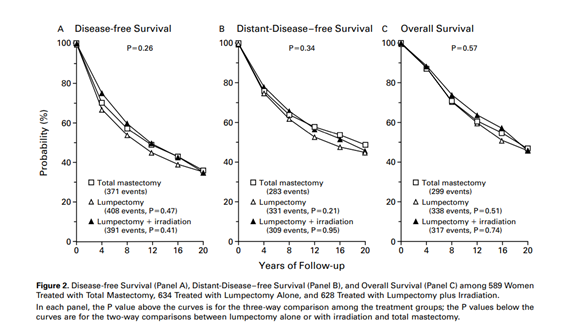
FIGURA 1 – Comparação entre mastectomia, cirurgia conservadora e cirurgia conservadora seguida de radioterapia. Fisher B et al. N Engl Med 2002;347(16):1233-1241.
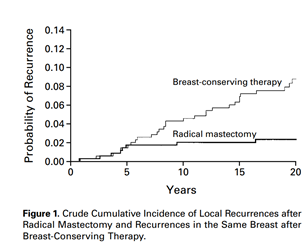
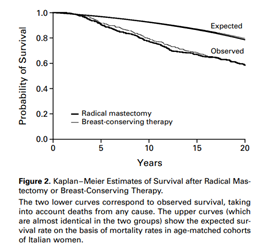
FIGURA 2 - Comparação entre mastectomia e cirurgia conservadora seguida de radioterapia. Veronesi U et al. N Engl J Med 2002;347(16): 1227-1232.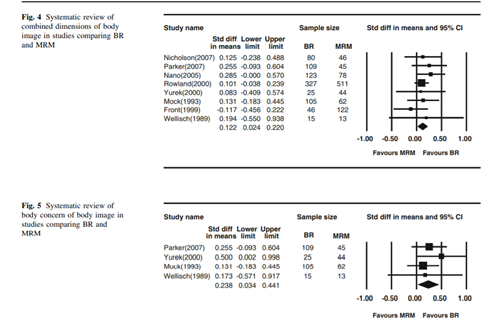 FIGURA 3 – Avaliação da imagem corporal entre mastectomia e mastectomia seguida de radioterapia. Fang SY, Shu BC, Chang YJ. Breast Cancer Res Treat. 2013 Jan;137(1):13-21.
FIGURA 3 – Avaliação da imagem corporal entre mastectomia e mastectomia seguida de radioterapia. Fang SY, Shu BC, Chang YJ. Breast Cancer Res Treat. 2013 Jan;137(1):13-21.
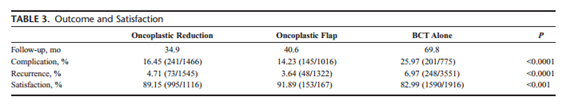 TABELA 1 - Resultados e satisfação entre cirurgia conservadora associada a mamoplastia, cirurgia conservadora associada a retalhos locorregionais e cirurgia conservadora isolada. Losken A et al. Ann Plast Surg 72:145.2014.
TABELA 1 - Resultados e satisfação entre cirurgia conservadora associada a mamoplastia, cirurgia conservadora associada a retalhos locorregionais e cirurgia conservadora isolada. Losken A et al. Ann Plast Surg 72:145.2014.
Tratamento sistêmico
Em 1975, sob liderança de Bernard Fisher, o NSABP (National Surgical Adjuvant Breast and Bowel Project) demonstrou melhor prognóstico em pacientes tratadas com 1-fenilalanina mostarda via oral adjuvante, colocando em prática conceito que já defendia que o pior prognóstico de alguns pacientes era devido a presença de micro metástases à distância. Surge assim o conceito de Fisher de que as doenças invasivas têm caráter sistêmico e, dessa forma, o tratamento precoce das micro metástases traz benefícios às pacientes15. A terapia sistêmica adjuvante, seja com quimioterapia, seja com hormonioterapia, passou a ter destaque importante no tratamento pós cirúrgico16. Com a eficácia das drogas no tratamento adjuvante, estudos foram conduzidos para aplicá-las no cenário neoadjuvante com objetivo de tornar tumores inoperáveis em operáveis e dentre eles destaca-se estudo conduzido por Bonadona em Milão17. Posteriormente, os estudos NSABP B-18 e B-27, além de demostrar que o prognóstico para pacientes era o mesmo quando realizada a quimioterapia neo ou adjuvante, evidenciaram maiores taxas de preservação das mamas frente à mastectomia quando o tratamento sistêmico era realizado antes da cirurgia. No estudo B-18, as pacientes foram submetidas à terapia com AC (adriamicina e ciclofosfamida) e o grupo de pacientes que iniciou o tratamento com quimioterapia apresentou maior taxa de cirurgia conservadora (69,8% vs. 59,8%) e número semelhante de recidiva local (HR=0,98; IC 95%: 0,83-1,15; p=0,78). Apesar do estudo não demostrar diferença em sobrevida global (SG), após nove anos de seguimento as pacientes que tiveram resposta patológica completa (RPC) apresentaram 50% de redução de risco de morte18. No estudo B-27 houve associação de taxano ao tratamento e os resultados foram semelhantes ao B-18 em relação a SG e sobrevida livre de doença (SLD) quando realizado tratamento neo ou adjuvante, mas com incremento tanto de SLD quanto de SG nas pacientes que atingiram RPC. Destaca-se que a associação de taxano no B-27 levou a maior taxa de RPC19. Com essas evidências e de outros estudos, as indicações para quimioterapia neoadjuvante se estabeleceram em: 1) tornar tumores inoperáveis em operáveis; 2) transformar cirurgias radicais em conservadoras; 3) tumores localmente avançados (T3, T4, N2-3)20.
A identificação dos receptores de estrogênio e progesterona, através de imuno-histoquímica, o advento das técnicas de hibridização in situ para detecção da amplificação de HER2 associados ao estudo de Perou e Sorlie, em 2000, trabalho que apresentou a classificação molecular do câncer de mama em cinco subgrupos (luminal A, luminal B, HER2 +, triplo-negativo ou basal like e normal like) foram um marco no início do tratamento mais personalizado das pacientes21-27. Ganharam espaço cada vez maior os tratamentos anti-hormônios, quimioterápicos e terapias-alvo adjuvantes, ampliando a indicação de quimioterapia neoadjuvante e permitindo, além das indicações até então empregadas e descritas acima, avaliar in vivo a resposta tumoral frente ao agente utilizado na neoadjuvância.
Acerca da utilização de terapias-alvo, merece destaque o anticorpo monoclonal trastuzumabe. Estudos compararam esquemas quimioterápicos usados rotineiramente com e sem associação com trastuzumabe e os esquemas de combinação se refletiram em maior SLD e SG para as pacientes. Entre os estudos podemos citar o NSABP B-31 (SLD = 62,3% vs. 73,7% HR 0,60 p<0,001; SG = 75,2% vs. 84% HR 0,63 p < 0,001) e BCIRG 006 (SLD = ACTH: HR 0,70, TCH: HR 0,76 p < 0,001; SG = ACTH: HR 0,64 p< 0,001, TCH: HR 0,76 p < 0,0081)28,29 No cenário neoadjuvante, os tumores triplo-negativos, assim como os HER2 positivos, e estes principalmente com associação de terapias-alvo, tendem a apresentar maior RPC. Assim, a tendência atual é realizar quimioterapia neoadjuvante em tumores com dimensões menores e com essas características biomoleculares30-32. Nos estudos NOAH e GEPARQUINTO a associação de trastuzumabe à quimioterapia em tumores com expressão positiva de HER2 levou a taxas de RPC de cerca de 50% - quase o dobro dos resultados sem a associação 30,32. O duplo bloqueio com trastuzumabe e pertuzumabe levou a maior taxa de RPC com aumento em torno de 20% em relação aos esquemas que utilizaram apenas trastuzumabe. No estudo NEOSPHERE, a taxa de RPC foi de 45,8% no grupo submetido ao duplo bloqueio vs. 29% no grupo de trastuzumabe e a publicação dos dados do estudo AFINITY na adjuvância em 2017 garantiu a aprovação definitiva do duplo bloqueio34. A indicação de duplo bloqueio na terapia neoadjuvante em tumores HER2+ foi impulsionada graças à publicação do estudo KATHERINE, que randomizou pacientes com tumores HER2+ com doença invasiva residual em mama e/ou axila após terapia inicial com quimioterapia e terapia anti-HER2 (trastuzumabe com ou sem pertuzumabe) para receberem no pós-operatório 14 ciclos de trastuzumabe-entansina (TDM-1) ou manter trastuzumabe por 14 ciclos. As pacientes randomizadas apresentavam estádio clínico T1-T4, N0-N3 e M0 excluindo T1aN0 ou T1bN0. O grupo que recebeu TDM-1 apresentou 50% de redução do risco de recorrência de doença invasiva (88,3% vs. 77%; HR: 0,50, IC 95% 0,39-0,64; p<0,001), mas o benefício de sobrevida global não alcançou significância estatística (94,3% vs. 92,5%; HR 0,70, IC 95% 0,47-1,05; p<0,08) 35 – FIGURA 4.
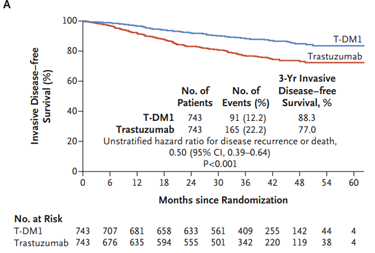
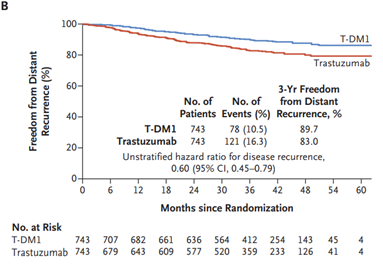
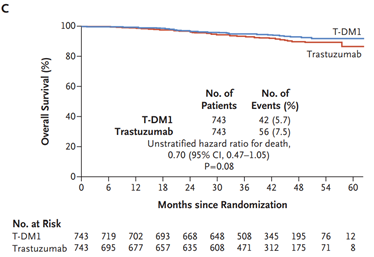 FIGURA 4 - Comparação entre o uso ou não de TDM-1 adjuvante pós neoadjuvância. von Minckwitz G et al. N Engl J Med 2019; 380:617-28.
FIGURA 4 - Comparação entre o uso ou não de TDM-1 adjuvante pós neoadjuvância. von Minckwitz G et al. N Engl J Med 2019; 380:617-28.
Com o objetivo de reduzir a cardiotoxidade, estudos foram realizados para avaliar o não emprego de antracíclicos na terapia neoadjuvante associada ao duplo bloqueio. O estudo TRAIN-2 randomizou 418 pacientes com estádio II e III, tumores HER2+, sem tratamento prévio e que foram randomizadas em: paclitaxell + carboplatina + trastuzumabe + pertuzumabe (PTC+P X 3) seguido de paclitaxell + carboplatina + trastuzumabe + pertuzumabe (X6), 206 pacientes e o outro grupo 5 fluouracil + epirrubicina + ciclofosfamida + trastuzumabe + pertuzumabe (FEC+T+P X 3) seguido de paclitaxell + carboplatina + trastuzumabe + pertuzumabe (X6), 212 pacientes. A resposta patológica completa ocorreu em 141 pacientes (67%, IC 95% 60-73) no grupo que recebeu antracíclicos e em 140 (68%, IC 95% 61-74) no grupo que não recebeu antracíclicos (p=0,95). A análise atualizada com 48,8 meses de seguimento demonstrou que não houve diferença na SLD e na SG entre os grupos, além da menor taxa de toxicidade cardíaca no grupo sem exposição a antracíclicos36.
Se por um lado novas terapias surgiram, por outro há tentativa de descalonamento do tratamento adjuvante em pacientes com expressão positiva de HER2 e isso pode ser aplicado em algumas situações, graças a novas evidências. No estudo APT, 410 pacientes com câncer de mama HER2-positivo, tumores de até 3 cm e linfonodos negativos receberam paclitaxell (80 mg/m2) com trastuzumabe por 12 semanas, seguido de trastuzumabe por 9 meses. Após seguimento médio de 6,5 anos a SLD foi de 93% (IC 95%, 90,4-96,2) e SG de 95% (IC 95%, 92,4-97,7). Merece destacar que 91% das pacientes estudadas apresentavam tumores de até 2 cm e 64% apresentavam tumores com expressão positiva de estrogênio37.
Em relação aos tumores triplo-negativos já se conhecia a boa resposta de um modo geral a terapias neoadjuvantes, principalmente com a associação de antracíclicos e taxanos e atualmente estudos têm demonstrado maiores taxas de RPC com emprego de carboplatina, como visto no estudo Alliance (RPC na mama: 44% vs. 60%, p = 0,001 e mama e axila: 54% vs. 41%, p=0,003), porém sem refletir até o momento ganho de SG38,39. A indicação de quimioterapia up front em tumores triplo-negativos ganhou espaço com os resultados do estudo CREATE-X no qual 910 pacientes com tumores invasivos residuais, HER2-, pós-neoadjuvância com antracíclicos, taxanos ou ambos foram randomizados para 6-8 ciclos de capecitabina 2500mg/m2 ou placebo. Em cinco anos o grupo que recebeu o medicamento apresentou maior SLD (74,1% vs. 67,6%, HR=0,70; IC 95%, 0,53-0,92; p=0,01) e maior SG (89,2% vs. 83,6%; HR=0.59; IC 95%, 0,39-0,90; p=0,01). No subgrupo de pacientes com tumores triplo-negativos, os ganhos foram mais expressivos tanto em relação a SLD (69,8% vs. 56,1%, HR=0,58; IC 95%, 0,39 -0,87) quanto em relação a SG (78,8% vs. 70,3%, HR=0,52; IC 95%, 0,30- 0,90). Nesse estudo, 15,4% das pacientes apresentavam tumores de até 2cm, as demais apresentavam tumores de maiores dimensões40. – FIGURA 5.
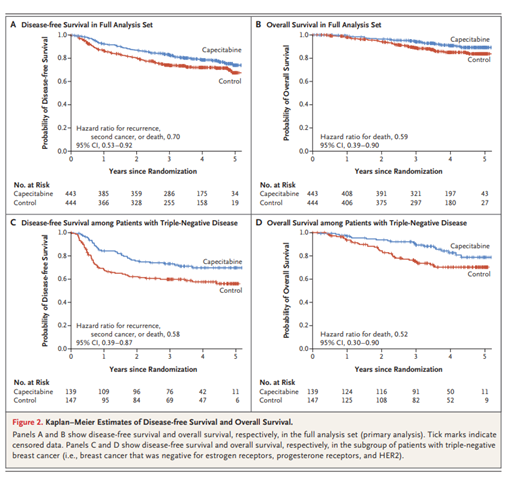
FIGURA 5 - Comparação entre o uso ou não de Capecitabina adjuvante pós neoadjuvância. Masuda N et al. N Engl J Med. 2017 Jun 1;376(22):2147-2159.
Com desenho semelhante, o estudo GEICAM/2003-11_CIBOMA/2004-01 não apresentou os mesmos resultados promissores. Foram randomizadas 876 pacientes com tumores triplo-negativos de 1cm ou mais, linfonodos negativos ou positivos, submetidas à quimioterapia neoadjuvante com antracíclicos com ou sem taxanos a receberem capecitabina (2000mg/m2) por 14 dias em ciclos de 21 dias por 8 ciclos ou observação. Em 5 anos houve maior SLD no grupo que recebeu capecitabina (79,6% vs. 76,8%; p=0,135), porém sem diferença estatística significante, e o mesmo ocorreu em relação à SG (86,2% vs. 85,9%; p=0,623). Análise de subgrupo sugeriu que há benefício de capecitabina no grupo de pacientes com tumores triplo-negativos do tipo não basal, mas o estudo não teve poder estatístico para comprovar tal achado41. Revisão sistemática com meta-análise recém-publicada avaliou 3842 pacientes com tumores triplo-negativos de 9 estudos clínicos randomizados, submetidas a capecitabina neo ou adjuvante. Os resultados da meta-análise e com baixa heterogeneidade foram aumento da SLD (HR = 0,75; IC 95%, 0,65–0,86; p < 0.001) e aumento da SG (HR = 0,63; IC 95%, 0,53–0,77; p < 0,001) quando se associou a capecitabina. Em análise de subgrupos há aumento da SLD nos grupos com adição de capecitabina (HR = 0,64; IC 95%, 0,53–0,78; p < 0,001), associação de capecitabina à quimioterapia adjuvante (HR = 0,73; 95% CI, 0,63–0,85; p < 0,001) e nas pacientes com linfonodos positivos (HR = 0,62; IC 95%, 0,44–0,86; p = 0.005). Em contrapartida, nos grupos em que houve substituição da capecitabina, pacientes em quimioterapia neoadjuvante e em pacientes com linfonodos negativos. Regimes com capecitabina foram relacionados a maiores riscos de diarreia (OR = 2,88, IC 95% 2,23–3,74, p < 0,001), estomatites (OR = 2,01, IC 95% 1,53–2,64, p < 0.001) e síndrome mão-pé (OR = 8,67, IC 95% 6,70–11,22, p < 0,001)42.
Novas drogas vêm sendo avaliadas no cenário neoadjuvante em pacientes com tumores triplo-negativos e dentre elas destaca-se a imunoterapia. O estudo KEYNOTE-522 avaliou pacientes estadios II e III, portadoras de tumores triplo-negativos, sem tratamento prévio, para receber quatro ciclos de pembrolizumabe (dose de 200 mg) a cada três semanas + paclitaxell e carboplatina (784 pacientes) ou placebo a cada três semanas + paclitaxell e carboplatina (390 pacientes). Os dois grupos receberam quatro ciclos adicionais de pembrolizumabe ou placebo, e ambos os grupos receberam doxorrubicina-ciclofosfamida ou epirrubicina-ciclofosfamida. Após a cirurgia, as pacientes receberam pembrolizumabe adjuvante ou placebo a cada três semanas até completar 9 ciclos. O uso do imunoterápico levou a maior RPC (64.8% vs. 51,2%; IC 95%, 5,4-21,8; p<0,001) e as pacientes mais beneficiadas com maiores taxas de RPC foram aquelas com comprometimento linfonodal ou estádio III. Em 15 meses de seguimento houve tendência favorável à SLD, mas sem diferença estatística significante43.
Em relação às pacientes com tumores luminais de estádio clínico inicial, a cirurgia segue como terapia primária. Com a publicação dos estudos SENTINA e ACOSOG-Z71 discute-se a terapia neoadjuvante com objetivo de downstaging axilar e desta forma realizar a pesquisa do linfonodo sentinela em axila primariamente comprometida44,45. Sabendo que a taxa de resposta dos tumores luminais à quimioterapia neoadjuvante é bem inferior se comparada aos triplo-negativos e HER2+, avaliou-se a realização de hormonioterapia neoadjuvante, entretanto revisão sistemática com meta-análise mostrou que a terapia neoadjuvante com inibidores de aromatase (IA) apresentou resposta clínica similar à quimioterapia (OR=1,08; IC 95%, 0,50–2,35; p = 0,85; n = 378), resposta radiológica similar (OR=1,38; IC 95%, 0,92–2,07; p = 0,12; n = 378) e taxas semelhantes de cirurgia conservadora (OR= 0,65; IC 95%, 0,41–1,03; p = 0.07; n = 334), mas com menos toxicidade.
Na comparação com tamoxifeno, os IA foram superiores em relação à resposta clínica (OR=1,69; IC 95%, 1,36–2,10; p < 0,001; n = 1352), resposta radiológica (OR=1,49; IC 95%, 1,18–1,89; p < 0,001; n = 1418) e taxas de cirurgia conservadora (OR=1,62; IC 95%, 1,24–2,12; p < 0,001; n = 918)46. Em estudo com 97 pacientes com tumores luminais, houve randomização para quimioterapia (epirrubicina 90mg/m2 + ciclofosfamida 600mg/m2 seguido de docetaxel 100mg/m2 a cada 21 dias X 4) ou exemestano 25mg por 24 semanas. Das pacientes que receberam quimioterapia, 51% estavam na pré- menopausa e 56% das que receberam hormonioterapia receberam goserrelina com exemestano. Análise de subgrupos mostrou benefício significativo da quimioterapia nas pacientes na pré-menopausa em relação às taxas de resposta clínica (75% vs. 44%; p=0,027). O mesmo não foi demonstrado nas pacientes na pós-menopausa (57% vs. 52%; p=0,78)47.
Discussão
Os conhecimentos atuais e que periodicamente são atualizados com novas evidências tornam o tratamento do câncer de mama cada vez mais personalizado, pois além dos tipos tumorais e estádios clínicos, devemos levar em consideração a idade das pacientes, comorbidades, suas expectativas e desejos. Ainda hoje, excluindo-se as pacientes em estádio IV, portadoras de tumores inoperáveis ou que não apresentam condições clínicas para tratamento operatório, a cirurgia é o tratamento mandatório, necessitando ou não de terapias sistêmicas neo, adjuvante ou ambas. Em relação aos tumores HER2+, as terapias-alvo, em especial o duplo bloqueio, permitiu alcançar altas taxas de RPC e, com os dados do estudo KATERINE, a adjuvância com TDM-1 aumentou a SLD de pacientes que não apresentaram resposta patológica completa de doença invasiva. Por sua vez, dados do estudo APT garantem a não-inferioridade do uso de trastuzumabe associado a paclitaxell adjuvantes sem antracíclicos, em tumores iniciais sem linfonodos comprometidos. O estudo CREATE-X é um marco no tratamento dos tumores triplo-negativos, pois a adjuvância com capecitabina pós-quimioterapia neoadjuvante em pacientes que não tiveram resposta patológica completa de doença invasiva levou a maior SLD e SG. A questão que ainda gera discussão é o tamanho do tumor para se indicar a neoadjuvância e isso se dá devido a resultados de outros estudos realizados. Nos tumores luminais iniciais, a cirurgia up front continua sendo o tratamento padrão, casos especiais são aqueles em que se busca downstaging axilar.
Conclusão
Atualmente, baseando-se em revisão da literatura e seguindo recomendações do National Comprehensive Cancer Network (NCCN) 2021, mas sempre com individualização das pacientes e discussão multidisciplinar, a cirurgia está indicada como terapia primária nas pacientes com câncer de mama inicial, já a terapia sistêmica neoadjuvante é a terapia up front nos tumores triplo-negativos e HER2+: cT≥2cm ou cN≥1 e nos tumores luminais quando a axila é comprometida e objetiva-se o downstaging axilar – FIGURAS 6 e 7.

FIGURA 6 – Princípios de terapia neoadjuvante. https://www.nccn.org – NCCN Guidelines Version 1.2021

FIGURA 7 – Princípios de terapia neoadjuvante. https://www.nccn.org – NCCN Guidelines Version 1.2021
Autores: Fábio Bagnoli1, Vilmar Marques de Oliveira2, José Francisco Rinaldi3
1 - Professor Doutor – Instrutor da Faculdade de Ciências Médicas da Santa Casa de São Paulo; Assistente do Setor de Mastologia da Santa Casa de São Paulo; Corresponsável pelo Ambulatório de Quimioterapia Mama da Santa Casa de São Paulo; Responsável pela Reconstrução Mamária da Equipe de Mastologia do Hospital Paulistano (Américas Serviços Médicos); Membro Titular da Sociedade Brasileira de Mastologia (SBM); Membro Titular do CPMO (Centro Paulista de Mastologia e Oncoplastia); Tesoureiro Adjunto da SBMSP (2020-2022); Membro das Comissões de Oncoplastia e Título de Especialista da SBM (2020-2022)
2 - Professor Doutor – Adjunto da Faculdade de Ciências Médicas da Santa Casa de São Paulo; Chefe do Setor de Mastologia da Santa Casa de São Paulo; Membro Titular da Sociedade Brasileira de Mastologia (SBM); Membro Titular do CPMO (Centro Paulista de Mastologia e Oncoplastia); Presidente da SBM (2020-2022)
3 - Professor Doutor – Assistente da Faculdade de Ciências Médicas da Santa Casa de São Paulo; Assistente do Setor de Mastologia da Santa Casa de São Paulo; Chefe-responsável pelo Ambulatório de Quimioterapia Mama da Santa Casa de São Paulo; Membro Titular da Sociedade Brasileira de Mastologia (SBM); Membro Titular do CPMO (Centro Paulista de Mastologia e Oncoplastia)
Referências bibliográficas
1 - Halsted WS. The results of operations for the cure of cancer of the breast performed at Johns Hopkins Hospital from June 1889 to January 1894. Johns Hopkins Hospital Hosp Rep 4:297,1894-1895.
2 - Grantley W. Taylor, Richard H. Wallace. Carcinoma of the Breast: Fifty Years Experience at the Massachusetts General Hospital. Ann Surg. 1950 Oct; 132(4): 833–838.
3 - Patey DH, Dyson WH. The prognosis of carcinoma of the breast in relation to the type of operation performed. Br J Cancer 2:7-13, 1948.
4 - Auchincloss H. Significance of location and number of axillary metastases in carcinoma of the breast. Ann Surg 1963;158:37-46.
5 - Madden JL. Modified radical mastectomy. Surg Gynecol Obstet 1965;121(6):1221-1230.
6 - De la Cruz L, Moody AM, Tappy EE et al. Overall survival, disease-free survival, local recurrence, and nipple-areolar recurrence in the setting of nipple-sparing mastectomy: a meta-analysis and systematic review. Ann surg oncol (2015)22:3241-3249.
7 - Galimberti V, Morigi C, Bagnardi V et al. Oncological Outcomes of Nipple-Sparing Mastectomy: A SingleCenter Experience of 1989 Patients. Ann Surg Oncol https://doi.org/10.1245/s10434-018-6759-0.
8 - Veronesi U, Cascinelli N, Mariani L et al. Twenty -year follow-up of a randomized study comparing breast -conserving surgery with radical mastectomy for early breast cancer. N Engl J Med 2002;347(16): 1227-1232.
9 - Fisher B, Anderson S, Bryant J et al. Twenty-years follow-up of a randomized trial comparing total mastectomy, lumpectomy and lumpectomy plus irradiation for the treatment of invasive breast cancer. N Engl Med 2002;347(16):1233-1241.
10 - https://www.nccn.org – NCCN Guidelines Version2021
11 - Fang SY, Shu BC, Chang The effect of breast reconstruction surgery on body image among women after mastectomy: a meta-analysis. Breast Cancer Res Treat. 2013 Jan;137(1):13-21.
12 - Losken A, Dugal CS, Styblo TM et al. A meta-analysis comparing breast conservation therapy alone to the oncoplastic technique. Ann Plast Surg 72:145.2014.
13 - Clough KB, Kroll SS, Audretsch W. An approach to the repair of partial mastectomy defects. Plast Reconstr Surg 104:409,1999.
14 - Wilder RJ: The historical development of the concept of metastasis. J Mt Sinai Hosp 23:728-734, 1956.
15 - Fisher B, Redmond C, Fisher ER. The contribution of recent NSABP clinical trials of primary breast cancer therapy to an understanding of tumor biology--an overview of findings. Cancer. 1980 Aug 15;46(4 Suppl):1009-25.
16 - Bonadona G, Valagussa P. Dose-response effect of adjuvant chemotherapy in breast cancer. N Engl J Med 304:10-15, 1981.
17 - Bonadonna. G. Conceptual and practical advances in the management of breast cancer. Karnofsky Memorial Lecture. J. Clin. Oncol., 7: 1380-1397, 1989.
18 - N Wolmark , J Wang, E Mamounas, J Bryant et al. Preoperative chemotherapy in patients with operable breast cancer: nine-year results from National Surgical Adjuvant Breast and Bowel Project B-18. J Natl Cancer Inst Monogr. 2001;(30):96-102.
19 - Priya Rastogi , Stewart J Anderson, Harry D Bear et al. Preoperative chemotherapy: updates of National Surgical Adjuvant Breast and Bowel Project Protocols B-18 and B-27. J Clin Oncol 2008 Feb 10;26(5):778-85.
20 - Chia S, Swain SM, Byrd DR, Mankoff DA. Locally advanced and inflammatory breast câncer. J Clin Oncol 2008;(26):786-90.
21 - Zaha DC. Significance of immunohistochemistry in breast câncer. World J Clin Oncol. 2014 Aug10;5(3):382-92.
22 - Anderson WF, Chatterjee N, Ershler WB et al. Estrogen receptor breast cancer phenotypes in the Surveillance, Epidemiology, and End Results database. Breast Cancer Res Treat. 2002 Nov;76(1):27-36.
23 - Clarke MJ. WITHDRAWN: Tamoxifen for early breast cancer. Cochrane Database Syst Rev. 2008 Oct 8;(4):CD000486.
24 - Winer EP, Hudis C, Burstein HJ et al. American Society of Clinical Oncology technology assessment on the use of aromatase inhibitors as adjuvant therapy for postmenopausal women with hormone receptor-positive breast cancer: status report 2004. J Clin Oncol 2005 Jan 20;23(3):619-29.
25 - Piccart-Gebhart MJ, Procter M, Leyland-Jones B et al. Trastuzumab after adjuvant chemotherapy in HER2-positive breast câncer. N Engl J Med 2005 Oct 20;353(16):1659-72.
26 - Wolff AC, Hammond ME, Schwartz JN et al. American Society of Clinical Oncology/College of American Pathologists guideline recommendations for human epidermal growth factor receptor 2 testing in breast cancer. Arch Pathol Lab Med. 2007;131(1):18-43.
27 - Perou CM, Sorlie T, Eisen MB et al. Molecular portraits of human breast tumours. Nature. 2000 Aug 17;406(6797):747-52.
28 - Perez EA, Romond EH, Suman VJ et al. Trastuzumab Plus Adjuvant Chemotherapy for Human Epidermal Growth Factor Receptor 2–Positive Breast Cancer: Planned Joint Analysis of Overall Survival From NSABP B-31 and NCCTG N9831. J Clin Oncol. 2014 32:3744-3752.
29 - Slamon D, Eiermann W, Robert N et al. Adjuvant Trastuzumab in HER2-Positive Breast Cancer. N Engl J Med. 2011 October 6; 365(14): 1273–1283.
30 - Semiglazov V , Eiermann W, Zambetti M et al. Surgery following neoadjuvant therapy in patients with HER2-positive locally advanced or inflammatory breast cancer participating in the NeOAdjuvant Herceptin (NOAH) study. Eur J Surg Oncol. 2011 Oct;37(10):856-63.
31 - von Minckwitz G , Untch M, BlohmerJ et al. Definition and impact of pathologic complete response on prognosis after neoadjuvant chemotherapy in various intrinsic breast cancer subtypes. J Clin Oncol. 2012 May 20;30(15):1796-804.
32 - Cortazar P, Zhang L, Untch M et al. Pathological complete response and long-term clinical benefit in breast cancer: the CTNeoBC pooled analysis. Lancet. 2014 Jul 12;384(9938):164-72.
33 - Luca Gianni , Wolfgang Eiermann, Vladimir Semiglazov et al. Neoadjuvant chemotherapy with trastuzumab followed by adjuvant trastuzumab versus neoadjuvant chemotherapy alone, in patients with HER2-positive locally advanced breast cancer (the NOAH trial): a randomised controlled superiority trial with a parallel HER2-negative cohort. Lancet. 2010 Jan 30;375(9712):377-84.
34 - GianniL, Pienkowski T, Im YH et al. Efficacy and safety of neoadjuvant pertuzumab and trastuzumab in women with locally advanced, inflammatory, or early HER2-positive breast cancer (NeoSphere): a randomised multicentre, open-label, phase 2 trial. ancet Oncol. 2012 Jan;13(1):25-32.
35 - von Minckwitz G, Huang CS, Mano MS et al. Trastuzumab Emtansine for Residual Invasive HER2-Positive Breast Cancer. N Engl J Med 2019; 380:617-28.
36 - van Ramshorst MS , van der Voort A, van Werkhoven ED et al. Neoadjuvant chemotherapy with or without anthracyclines in the presence of dual HER2 blockade for HER2-positive breast cancer (TRAIN-2): a multicentre, open-label, randomised, phase 3 trial. Lancet Oncol. 2018 Dec;19(12):1630-1640.
37 - Sara M Tolaney, Hao Guo, Sonia Pernas et al. Seven-Year Follow-Up Analysis of Adjuvant Paclitaxell and Trastuzumab Trial for Node-Negative, Human Epidermal Growth Factor Receptor 2-Positive Breast Cancer. J Clin Oncol. 2019 Aug 1;37(22):1868-1875.
38 - Sikov WM, Berry DA, Perou CM et al. Impact of the addition of carboplatin and/or bevacizumab to neoadjuvant once-per-week paclitaxell followed by dose-dense doxorubicin and cyclophosphamide on pathologic complete response rates in stage II to III triple-negative breast cancer: CALGB 40603 (Alliance). J Clin Oncol. 2015 Jan 1;33(1):13-21.
39 - Poggio F, Bruzzone M, Ceppi M et al. Platinum-based neoadjuvant chemotherapy in triple-negative breast cancer: a systematic review and meta-analysis. Ann Oncol. 2018 Jul 1;29(7):1497-1508.
40 - Masuda N , Lee S J, Ohtani S et al. Adjuvant Capecitabine for Breast Cancer after Preoperative Chemotherapy. N Engl J Med. 2017 Jun 1;376(22):2147-2159.
41 - A, Barrios CH , Torrecillas L et al. Phase III Trial of Adjuvant Capecitabine After Standard Neo-/Adjuvant Chemotherapy in Patients With Early Triple-Negative Breast Cancer (GEICAM/2003-11_CIBOMA/2004-01). J Clin Oncol. 2020 Jan 20;38(3):203-213.
42 - Huo X, Li J, Zhao F et al. The role of capecitabine-based neoadjuvant and adjuvant chemotherapy in early-stage triple-negative breast cancer: a systematic review and meta-analysis. BMC Cancer (2021) 21:78.
43 - Peter Schmid, Javier Cortes, Lajos Pusztai et al. Pembrolizumab for Early Triple-Negative Breast Cancer. N Engl J Med. 2020 Feb 27;382(9):810-821.
44 - Kuehn T, Bauerfeind I, Fehm T et al. Sentinel-lymph-node biopsy in patients with breast cancer before and after neoadjuvant chemotherapy (SENTINA): a prospective, multicentre cohort study. Lancet Oncol. 2013 Jun;14(7):609-18.
45 - Boughey JC, Suman VJ, Mittendorf EA et al. Sentinel lymph node surgery after neoadjuvant chemotherapy in patients with node-positive breast cancer: the ACOSOG Z1071 (Alliance) clinical trial. JAMA. 2013 Oct 9;310(14):1455-61.
46 - Spring LM, Gupta A, Reynolds KL et al. Neoadjuvant Endocrine Therapy for Estrogen Receptor-Positive Breast Cancer: A Systematic Review and Meta-analysis. JAMA Oncol. 2016 Nov 1;2(11):1477-1486.
47 - E Alba, L Calvo, J Albanell et al. Chemotherapy (CT) and hormonotherapy (HT) as neoadjuvant treatment in luminal breast cancer patients: results from the GEICAM/2006-03, a multicenter, randomized, phase-II study. Ann Oncol. 2012 Dec;23(12):3069-3074.








