Bottom-Line
Os índices prognósticos no câncer de mama tradicionais incluem o Nottingham Prognostic Indicator (NPI), os critérios de St. Gallen, as diretrizes de consenso do NIH e o Adjuvant!Online, todos baseados em critérios clínicos do tumor e paciente. O advento da tecnologia genômica permitiu o desenvolvimento de novos testes baseados na biologia. Ao contrário dos fatores prognósticos anatômicos, os testes genômicos podem apresentar uma interação entre a natureza dos genes incluídos em um perfil específico e o benefício da terapia sistêmica. Estes podem ser avaliados por plataformas avançadas como Oncotype, MammaPrint, BCI, entre outros, que tentam através do estudo genômico do tumor mostrar se o paciente teria benefício ou não em certas terapias propostas na rotina oncológica. A utilização das assinaturas genômicas auxilia de maneira substancial a decisão da terapia adjuvante, mas o custo destes testes ainda é elevado, o que dificulta o acesso e limita seu uso na prática diária.
André Mattar (foto) é mastologista e Diretor do núcleo de Oncologia Clínica e Assistente do Centro de Pesquisa Clínica do Hospital Pérola Byington.
André Mattar1, Guilherme Ribeiro Fonseca2, Murilo Barato Agudo Romão3
- Mastologista, Diretor do núcleo de Oncologia Clínica e Assistente do Centro de Pesquisa Clínica do Hospital Pérola Byington
- Mastologista, Assistente do Centro de Pesquisa Clínica do Hospital Pérola Byington
- Mastologista, Assistente do núcleo de oncologia do Hospital Pérola Byington
Resumo
A grande maioria dos cânceres de mama hoje é identificada em um estágio clinicamente curável, mas todos apresentam o potencial risco de desenvolver doença metastática. O tratamento adjuvante visa diminuir de maneira significativa este risco e identificar aqueles pacientes com alto potencial de progressão. Com o desenvolvimento de novas tecnologias, estudos moleculares tumorais e analises mais aprofundadas dos tratamentos, conseguimos avançar de maneira importante em relação ao aumento das taxas de sobrevida e redução de toxicidade. Hoje, podemos lançar mão de ferramentas extremamente desenvolvidas que nos auxiliam a decidir qual o melhor caminho a se tomar, visando melhorar o tratamento e o prognóstico. Os índices prognósticos no câncer de mama tradicionais incluem o Nottingham Prognostic Indicator (NPI), os critérios de St. Gallen, as diretrizes de consenso do NIH e o Adjuvant!Online, todos baseados em critérios clínicos do tumor e paciente. O advento da tecnologia genômica permitiu o desenvolvimento de novos testes baseados na biologia. Ao contrário dos fatores prognósticos anatômicos, os testes genômicos podem apresentar uma interação entre a natureza dos genes incluídos em um perfil específico e o benefício da terapia sistêmica. Estes podem ser avaliados por plataformas avançadas, como Oncotype, MammaPrint, BCI, entre outros, que tentam através do estudo genômico do tumor mostrar se o paciente teria benefício ou não em certas terapias propostas na rotina oncológica. A utilização das assinaturas genômicas auxilia de maneira substancial a decisão da terapia adjuvante. Porém, o custo destes testes ainda é elevado, o que dificulta o acesso e limita seu uso na prática diária.
Palavras-chave: Câncer de mama; assinaturas genômicas; adjuvância
Introdução
Mais de 90% dos cânceres de mama são identificados em um estágio clinicamente curável, mas todos correm o potencial risco de desenvolver doença metastática. O tratamento adjuvante visa diminuir de maneira significativa este risco e identificar aqueles pacientes com maior risco de progressão é crucial para definir o melhor tratamento. A quimioterapia adjuvante apresenta uma série de efeitos colaterais, tanto imediatos quanto tardios, e identificar com exatidão qual o grupo de pacientes que tem maior benefício com este tipo de tratamento tem sido um desafio, porque nem sempre os dados clínicos, anatomopatológicos e imunohistoquímicos são suficientes para classificar adequadamente o risco individual.
O tratamento do câncer de mama até pouco tempo atrás se baseava em cirurgias mais agressivas seguidas de quimioterapia, que por muitas vezes apresentam efeitos adversos importantes e nem sempre apresentam boa resposta ao tratamento. Com o desenvolvimento de novas tecnologias, estudos moleculares tumorais e análises mais aprofundadas dos tratamentos, conseguimos avançar de maneira importante em relação ao aumento das taxas de sobrevida e redução de toxicidade. Hoje, podemos lançar mão de ferramentas extremamente desenvolvidas que nos auxiliam a decidir qual o melhor caminho a se tomar, se devemos utilizar quimioterapia ou se a mesma não terá beneficio no tratamento e prognóstico. Sabemos que a cirurgia seguida de hormonioterapia (e eventualmente radioterapia) seria, na maior parte das vezes, suficiente para aumentar a sobrevida global e sobrevida livre de recorrências, porém identificar quais pacientes necessitam de quimioterapia ainda é muitas vezes difícil. Os índices prognósticos no câncer de mama tradicionais incluem o Nottingham Prognostic Indicator (NPI), os critérios de St. Gallen, as diretrizes de consenso do NIH e o Adjuvant!Online, todos baseados em critérios como tamanho do tumor, grau, status dos linfonodos e status dos receptores hormonais para prever o resultado clínico do paciente.
O advento da tecnologia genômica permitiu o desenvolvimento de novos testes baseados na biologia. Ao contrário dos fatores prognósticos anatômicos, os testes genômicos podem apresentar uma interação entre a natureza dos genes incluídos em um perfil específico e o benefício da terapia sistêmica. A analogia mais óbvia é a interação entre o status do receptor hormonal e o benefício da quimioterapia8.
Estabelecer a relevância terapêutica é tipicamente mais difícil de se fazer do que a relevância prognóstica. A relevância terapêutica requer um ensaio clínico randomizado prospectivo projetado para testar o marcador ou estudos realizados em uma população razoavelmente homogênea, com aferição prospectiva de dados clínicos, representação de amostras tumorais e definições de perfil definidas a priori9.
Na literatura temos muitos trabalhos publicados nos últimos anos a este respeito e cinco testes genômicos prognósticos mostraram-se promissores nessa área e estão relativamente bem caracterizados.
OncotypeDx
O OncotypeDx foi desenvolvido com a avaliação de 21 genes utilizando métodos únicos e representa um dos ensaios de expressão gênica mais validados10. O estudo inicial utilizou amostras de 447 pacientes resgatados de bases de dados de pacientes que eram na maior parte linfonodos negativos e receptores hormonais positivos. Utilizou-se uma técnica de qRT-PCR (Reverse transcription polymerase chain reaction quantitative real time) que permite o exame de um número limitado de genes de tecido fixado com formalina, foi correlacionada a expressão gênica com recorrência a distância. Dos 250 genes inicialmente analisados foram selecionados 21 sendo 16 genes relacionados ao câncer e 5 genes de referência. Este ensaio pode ser realizado em amostras fixas de tumores e não requer amostras congeladas. O resultado é dado em risco de recorrência (Recurrence Score® - RS) que varia de 0 a 100 (Figura 1).
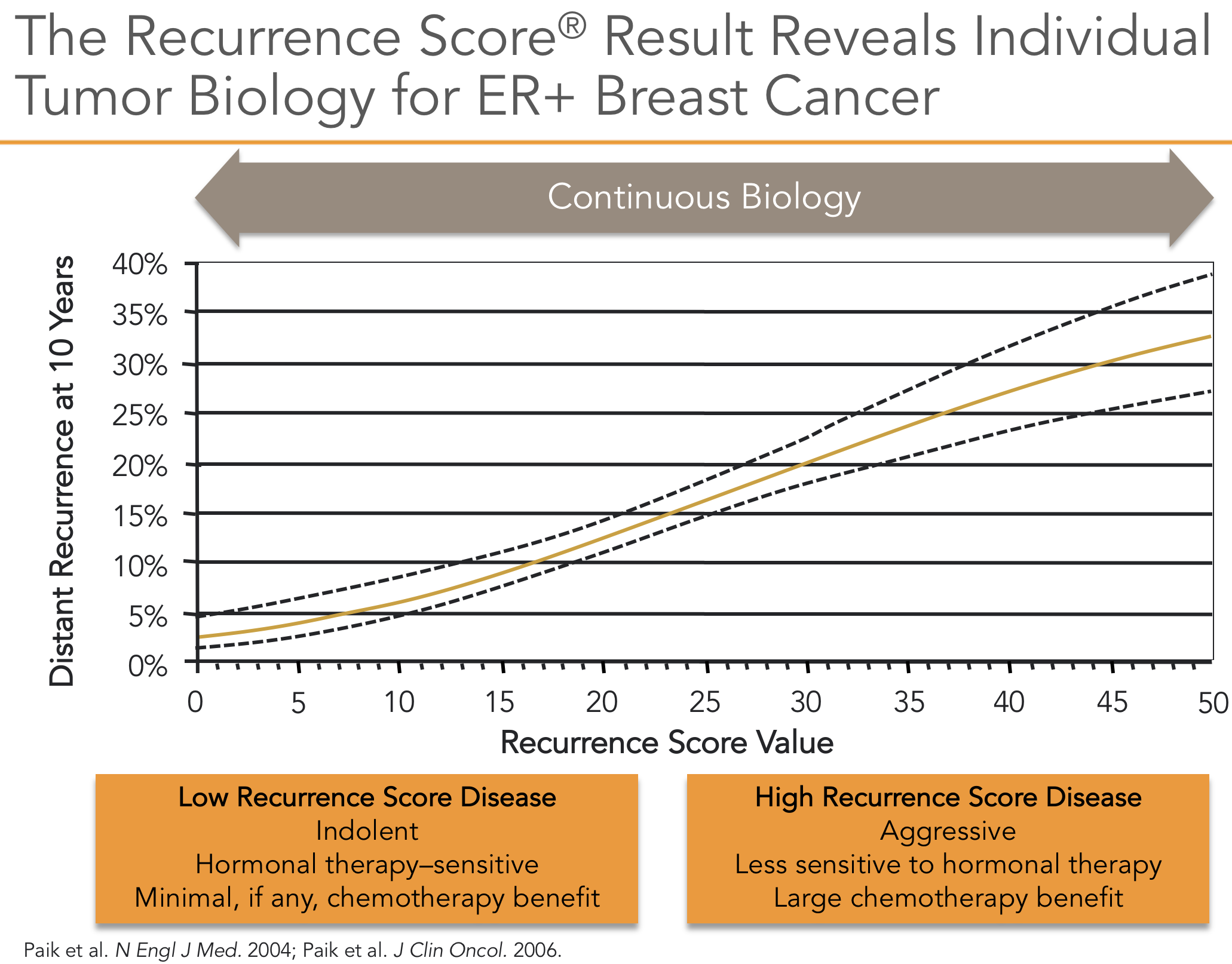
O RS foi validado em um conjunto de dados independente derivado de amostras coletadas no estudo cooperativo B-14 do NSABP (National Surgical Adjuvant Breast and Intellant Breast Project)11, que examinou o benefício do tamoxifeno adjuvante em pacientes com câncer de mama receptor de hormônio positivo e linfonodo negativo10. Nos pacientes classificados como de baixo risco pelo RS (RS <18), apenas 7% recidivaram apesar do tamoxifeno adjuvante, em comparação com pacientes de alto risco (RS > 31), dos quais 31% recaíram. Atualmente, mulheres na pós-menopausa com tumores receptores estrogênio (RE)-positivos são frequentemente tratadas com inibidores da aromatase por apresentarem melhor resposta12 e esta situação não foi testada neste estudo.
O valor prognóstico do RS foi ainda confirmado na análise retrospectiva do ensaio Arimidex, Tamoxifen, Alone ou Combination (ATAC)13, que avaliou a eficácia e segurança de 5 anos de anastrozol, tamoxifeno ou a combinação de ambos os tratamentos em mais de 4.000 mulheres na pós-menopausa14. O RS foi significativamente associado a metástases à distância, tanto para tumores com linfonodos positivos quanto para linfonodos negativos, e forneceu informações prognósticas significativas além do Adjuvant!Online. Nos tumores com linfonodos negativos, a razão de risco (hazard ratio - HR) ajustada entre os grupos com RS alto e baixo foi de 5,2 (IC 95% 2,7-10,1), e a HR entre os grupos com RS intermediário e baixo foi de 2,5 (IC 95% 1,3 a 4,5). Nos tumores com linfonodos positivos, a HR ajustada entre os grupos com RS alto e baixo foi de 2,7 (IC95% 1,5–5,1) e a HR entre os grupos com RS intermediário e baixo foi de 1,8 (IC95% 1,0–3,2). A taxa de metástase à distância para o grupo RS baixa foi de 17. O RS foi ainda validado em populações de pacientes com câncer de mama tratados com hormonioterapia com ou sem linfonodos positivos. Por essa razão, não ficou claro se sua capacidade prognóstica reflete o prognóstico verdadeiro, a previsão da falta de benefício do tamoxifeno ou ambos.
Em um estudo caso-controle de base populacional, o RS forneceu informações prognósticas independentes em pacientes não tratados, sugerindo um papel puramente prognóstico, além do preditor previamente sugerido para sensibilidade endócrina15. Felizmente, além de predizer pior resultado apesar da terapia endócrina, um RS alto também prediz benefício da quimioterapia16, 17.
No estudo SWOG 881418, 1.477 mulheres na pós-menopausa com câncer de mama receptor hormonal (RH) positivo foram randomizadas para receber tamoxifeno isolado, quimioterapia (ciclofosfamida, doxorubicina e 5-fluorouracil - CAF) mais tamoxifeno concomitantemente ou quimioterapia com CAF seguida de tamoxifeno19; O estudo revelou um benefício da quimioterapia, particularmente dada sequencialmente com o tamoxifeno. O RS foi realizado em 367 tumores do braço sequencial CAF-tamoxifeno do estudo, revelando que na população com linfonodos positivos o RS foi prognóstico em todas as categorias nodais. Além disso, o benefício da adição de CAF ao tamoxifeno foi observado apenas naqueles com alto RS (Figura 2).
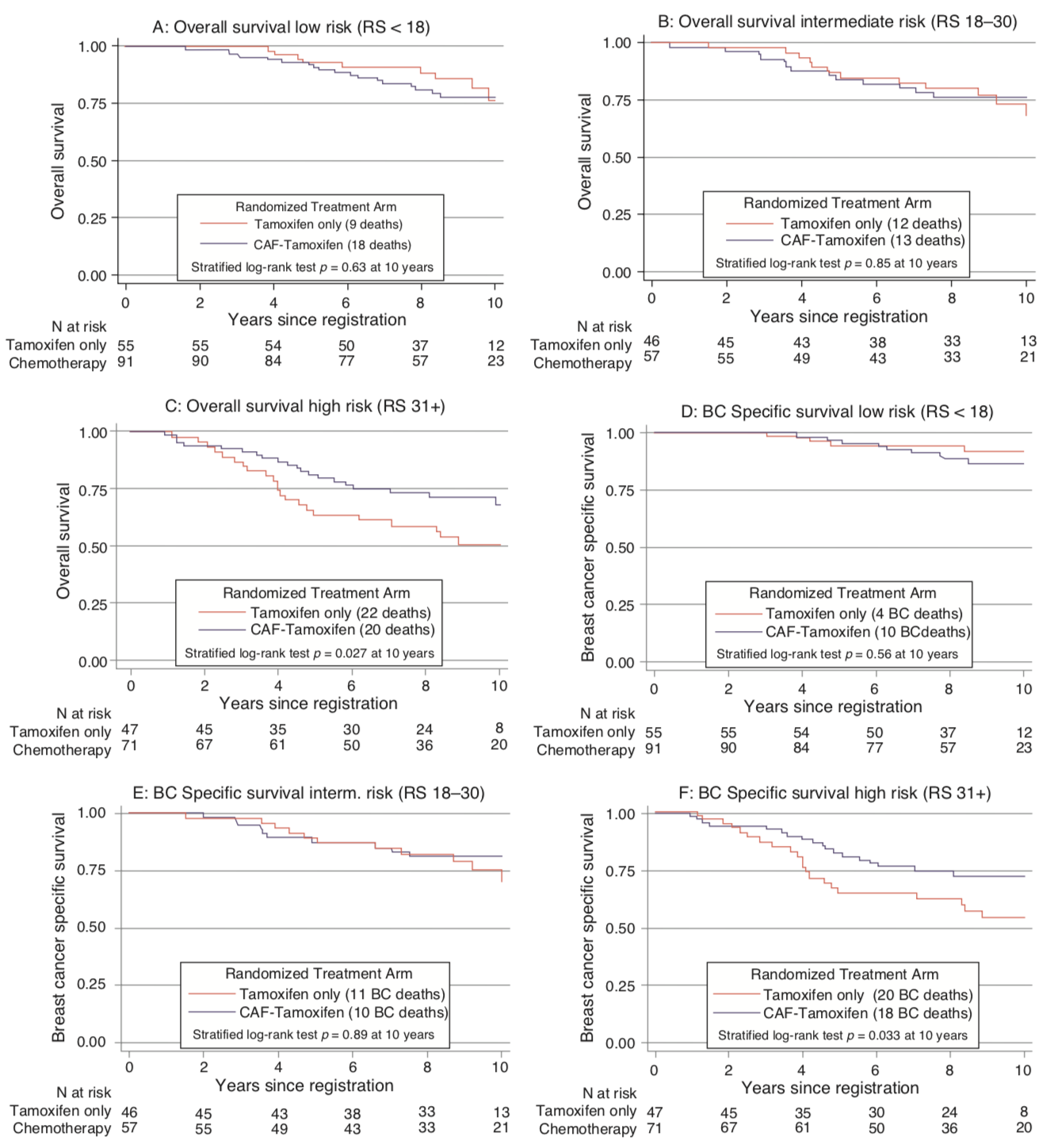
A advertência para a aplicação clínica desse achado ao câncer de mama com linfonodos positivos é que este é um regime mais antigo e, mesmo no grupo de baixo risco, a sobrevida livre de doença em longo prazo foi de apenas 60%. Para responder de maneira definitiva esta questão sobre o grupo de pacientes linfonodo positivo foi desenhado o estudo RxPONDER (The Treatment (Rx) for Positive Node, Endocrine Responsive Breast cancer - SWOG S1007, ClinicalTrials.gov identificador NCT01272037). É um ensaio clínico de Fase III que avalia RS baixo em pacientes com linfonodos positivos. Espera-se que o estudo registre aproximadamente 10.000 pacientes com tumores RH positivos e com linfonodos positivos (1–3 linfonodos) e negativos para HER2 e tenham RS ≤ 25 pelo OncotypeDx®. Os pacientes foram randomizados receber terapia hormonal (tamoxifeno, anastrozol, letrozol ou exemestano) com ou sem quimioterapia. O estudo também visa determinar o ponto de corte ideal para o escore RS em pacientes com linfonodos positivos.
O estudo TailorX2, com atualização publicada em 201820, utilizou a plataforma genômica do OncotypeDx, para avaliar tumores através de escore de recorrência classificados de 0 a 100 sobre o valor preditivo de benefício da quimioterapia e também quanto ao valor prognostico de recorrência à distância (Figura 3)10, 17. 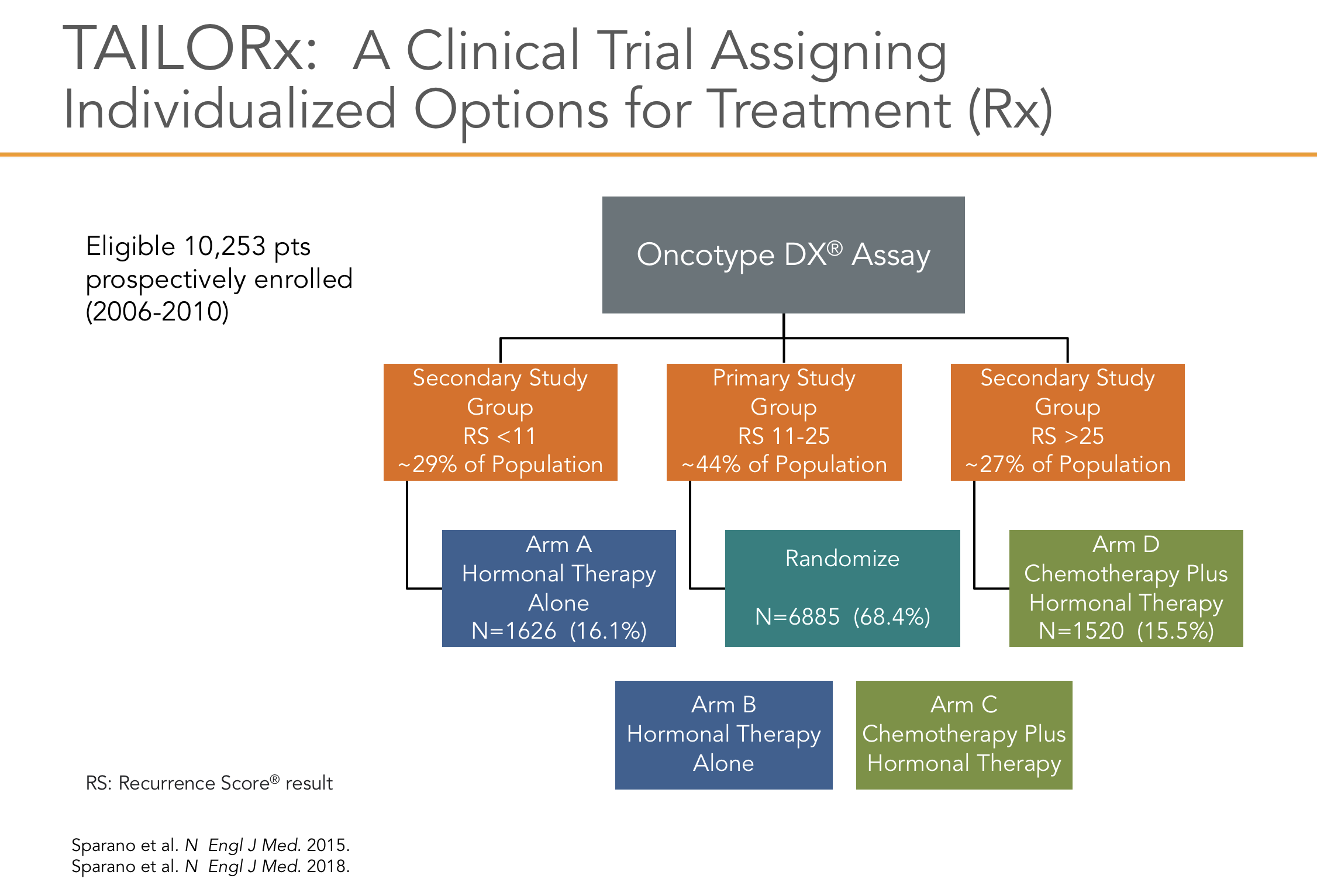
O estudo foi desenhado com a intenção de avaliar o benefício da quimioterapia em pacientes consideradas de risco intermediário, que foram classificadas neste estudo entre os escores 11 a 25 (os valores foram reduzidos do valor de referência do teste pelo risco de subtratamento de alguns pacientes), pois já sabíamos por atualização anterior que em paciente com escores abaixo de 10, o uso exclusivo de hormonioterapia mostrava os mesmos benefícios (em relação à sobrevida global e sobrevida livre de recorrência) que a associação das terapias (quimioterapia seguida de hormonioterapia). Foram incluídas 9719 pacientes, receptor hormonal positivo, Her2 negativo, com tumores entre 1.1 a 5.0 cm, sendo 6711 do grupo intermediário. Após a análise dos dados em follow-up de 96 meses para sobrevida global, concluiu-se que a quimioterapia não tinha benefício em pacientes acima de 50 anos até o escore de 25, mas para aquelas com menos de 50 anos pode ter benefício adicional, a depender do valor do escore (7% de beneficio em escore de 21 a 25 e 1.5% de 15 a 20)20.
Atualmente o teste OncotypeDx é recomendado como uma ferramenta de tomada de decisões clínicas para pacientes com câncer de mama positivo para receptor de hormônio e linfonodo positivo pela Sociedade Americana de Oncologia Clínica21 e pelo Consenso de Especialistas Internacionais de St. Gallen de 20118.
Mammaprint
O Mammaprint foi criado por análise de amostras de tumores congelados do Instituto de Câncer dos Países Baixos (Netherlands Cancer Institute). Os 98 tumores iniciais incluíram 78 de linfonodos negativos com menos de 55 anos de idade, 34 de 78 (44%) desenvolveram metástases à distância em 5 anos e 44 de 78 (56%) não desenvolveram nenhuma doença à distância. Ao comparar os perfis de expressão gênica dos tumores com e sem metástases à distância subsequentes, identificou-se um conjunto de 70 genes. Desde esta publicação inicial, houve pelo menos seis estudos de validação externa do perfil prognóstico Mammaprint. A primeira foi uma análise retrospectiva de 295 pacientes que tinham menos de 53 anos de idade com tumores T1–2, tanto linfonodos negativos (151 pacientes) quanto linfonodos positivos (144 pacientes), com ou sem terapia adjuvante e seguidos por quase 7 anos22. Dos 295 pacientes, 180 foram classificados como tendo uma assinatura de alto risco e 115 como tendo uma assinatura de baixo risco. A média de cinco anos de sobrevida para o grupo de pacientes com assinatura de alto risco foi de 74% versus 97% para os de baixo risco. Essa assinatura foi capaz de predizer o prognóstico independente do status linfonodal e permaneceu significativa na análise multivariada (tamanho do tumor, envolvimento nodal e uso de quimioterapia adjuvante).
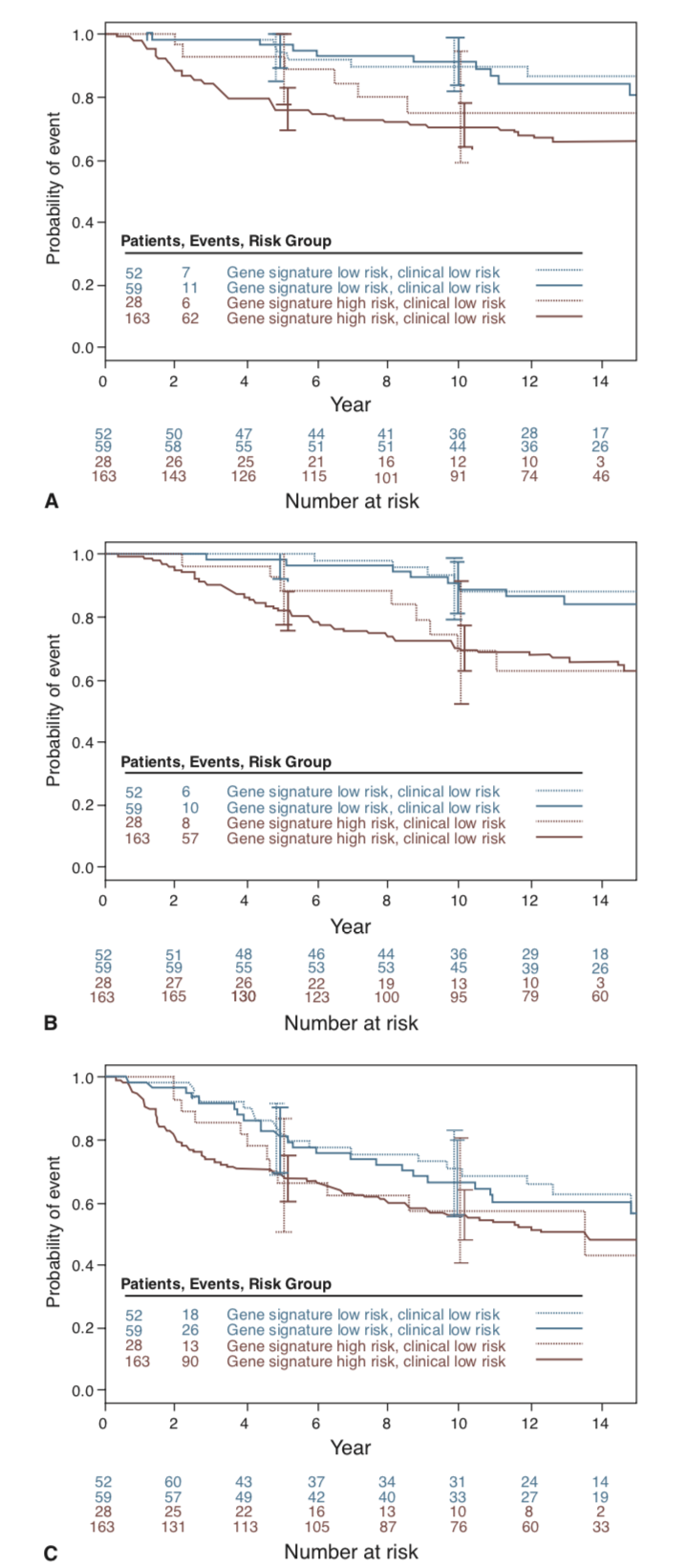
Um segundo estudo de validação retrospectiva, menos heterogêneo e verdadeiramente independente, foi realizado em 302 mulheres tratadas em várias instituições europeias23. Realizando um ajuste de risco clínico conforme avaliado pelo Adjuvant!Online, o Mammaprint foi capaz de predizer o risco de metástases à distância (razão de risco [HR] 2,13, intervalo de confiança de 95% [IC] 1,19–3,82) e sobrevida global (HR 2,63, IC 95% 1,45-4,79); entretanto, não conseguiu predizer significativamente a sobrevida livre de doença (HR 1,36; IC 95% 0,91-2,03) (figura 4)23.
Em estudos adicionais, a assinatura também previu metástase em pacientes (total de 148) com idade entre 55 e 70 anos, com tumores T1-2 sem comprometimento linfonodal de 1984 a 199624. Ajustada para as características de risco clínico, a assinatura foi novamente um forte fator prognóstico para metástases à distância, especialmente nos primeiros cinco anos (HR 14,4, IC 95% 1,7-122). O desempenho desta assinatura também foi avaliado em 241 pacientes com tumores de mama T1-3 com comprometimento linfonodal (1-3) diagnosticados entre 1994 e 2001 em vários institutos europeus25. Noventa pacientes (44%) foram classificados como tendo bom prognóstico pela assinatura, que foi significativamente prognóstica na previsão da sobrevida específica do câncer de mama além das variáveis clínicas padrão (HR 7,17, 95% IC 1,81-28,43).
O Mammaprint é melhor para prever precocemente (antes dos 5 anos) do que a recaída posterior1. Um obstáculo anterior ao uso em larga escala da assinatura do Mammaprint® foi a necessidade de uma quantidade significativa de tecido congelado, que era um grande impedimento para o uso nos Estados Unidos26. O teste está agora também disponível para uso em tecidos em parafina.
A evidência de nível I de sua utilidade clínica foi consagrada no MINDACT (Microarray In Node-negative and 1 to 3 node positive Disease may Avoid ChemoTherapy)27, no qual de uma coorte de 11 mil pacientes, 6.693 mulheres foram incluídas e divididas em grupos conforme o risco clínico utilizando-se o Adjuvant! Online e a seguir o risco genônico estipulado pelo Mammaprint. Os grupos concordantes de alto risco (clínico e genômico) que correspondiam a 27% da amostra foram submetidos à quimioterapia. Os grupos de baixo risco (clínico e genômico) que correspondiam a 41% das pacientes foram submetidos apenas a hormonioterapia. Quando esses dois testes divergiram, os pacientes foram randomizados para serem tratados de acordo com a avaliação de risco por Adjuvant! Online ou assinatura. Neste grupo, que correspondiam a 32% dos casos (2.142 pacientes), foram randomizadas para receber ou não quimioterapia (Figura 5).
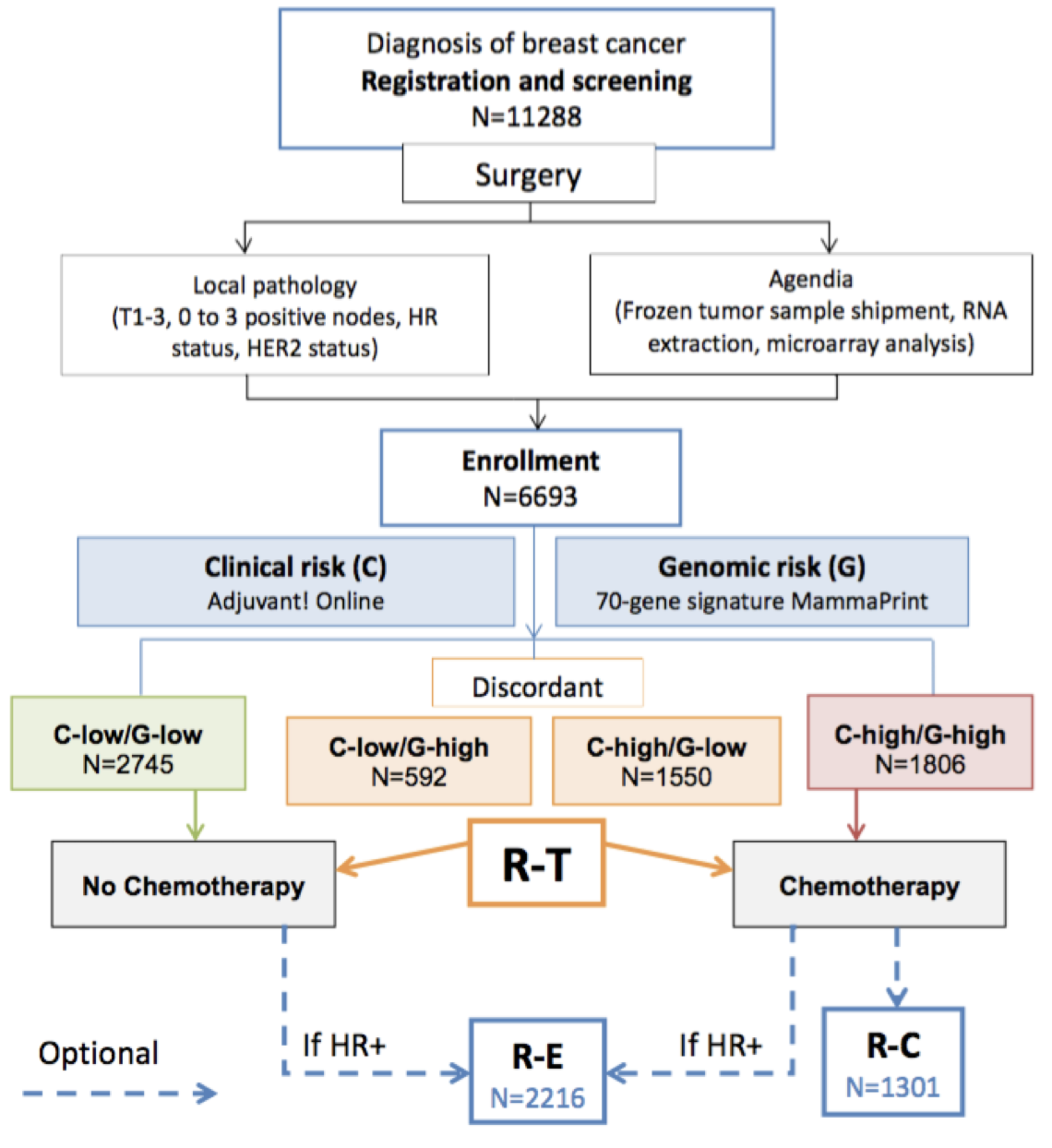
Pacientes consideradas como alto risco clínico e baixo risco genômico (1550 - 23,2%) apresentaram aos 5 anos de seguimento uma taxa de sobrevida sem metástases à distância de 94,7% (IC 95%, 92,5 a 96,2) entre aquelas que não receberam quimioterapia. A diferença absoluta entre esses pacientes e aqueles que receberam quimioterapia foi de 1,5 pontos percentuais, com a taxa sendo menor sem quimioterapia. Análise multivariada não mostrou qualquer benefício em subgrupo (receptor de estrógeno positivo, HER2 ou linfonodo positivo ou negativo). Assim, aproximadamente 46% das pacientes com alto risco clínico podem não necessitar de quimioterapia28.
Breast Cancer Index
O Breast Cancer Index (BCI) é um teste prognóstico para o risco de desenvolver metástases à distância em pacientes com tumores RH positivo. Este teste é uma combinação de uma assinatura de 2 genes previamente identificada (HOX13: IL17BR) e um índice de grau molecular do tumor de cinco genes ([MGI] BUB1B, CENPA, NEK2, RACGAP1 e RRM2)29.
O desenvolvimento desta assinatura começou a partir de 22.000 matrizes de genes realizadas em 60 mulheres com câncer de mama RH positivo e linfonodos positivos tratadas com tamoxifeno e acompanhadas por pelo menos 5 anos30. O valor prognóstico deste teste para recorrência à distância foi então confirmado usando um subconjunto de 588 pacientes do estudo randomizado de Estocolmo31. Posteriormente, o BCI foi desenvolvido para fornecer avaliação de risco individual. Os tumores foram categorizados em três grupos de risco como de baixo risco se BCI <5, intermediário se BCI 5 ≥ e <6,4 e alto risco se BCI ≥6,4. O classificador de risco da BCI identificou pacientes com taxas de metástase distantes significativamente diferentes aos 10 anos do braço não tratado do estudo de Estocolmo31, com uma diferença absoluta de 20% entre os grupos de baixo risco e alto. O desempenho do teste BCI na previsão do risco de recorrência à distância para além das variáveis clínicas e patológico padrão foi também avaliado no estudo ATAC32. Pacientes com escore de BCI baixo após 5 anos usando hormonioterapia podem ter seu tratamento suspenso. Já as pacientes com escore de BCI alto devem se manter em tratamento com hormonioterapia por mais 5 anos (total de 10 anos).
PROSIGNA
O PROSIGNA® (também conhecido como PAM50) avalia a expressão tumoral de 50 genes tendo como objetivo a avaliação do risco de recorrência a distancia do tumor. Usando um modelo multivariável de Cox e um ajuste de regressão de Ridge, o PAM50 foi testado em uma coorte de pacientes com tumores com linfonodos negativos que não receberam terapia sistêmica adjuvante22. Este teste pode ser usado em pacientes na pós-menopausa com tumores em estádios I E II, com receptores de estrogênio (RE) positivos e até 3 linfonodos axilares comprometidos. Estas mulheres são classificadas em baixo risco (0–40), risco intermediário (40-60) e alto risco (maior que 60). O teste auxilia na tomada de decisão do tratamento decidindo sobre o uso da quimioterapia adjuvante ou ate mesmo da terapia hormonal estendida. O escore ROR do PAM50 é capaz de identificar um grupo de risco muito baixo entre mulheres com tumores com linfonodo negativo, positivos para o RE, tratados apenas com tamoxifeno adjuvante. O valor prognóstico do ensaio PAM50 para prever o risco de recorrência à distância em mulheres pós-menopausa com tumores RH-positivos que receberam endocrinoterapia também foi validado recentemente em 1.400 pacientes do estudo ABCSG8 (Austrian Breast & Colorretal Cancer Study Group 8)33.
EndoPredict®
Outra nova assinatura multigene baseada em qPCR conhecida como EndoPredict® (EP) foi desenvolvida para prever o risco de recorrência de tumores RE-positivos, HER2-negativos34. Este teste baseia-se na expressão de oito genes, representando primariamente a proliferação e a sinalização relacionada aos receptores hormonais, desenvolvidos para serem utilizados em materiais de biópsia em parafina. Utilizando uma coorte combinada de 1.702 tumores RE positivo, Her2 negativos tratados com terapia endócrina apenas, de dois grandes ensaios de Fase III (ABCSG6 e ABCSG8). Usando as características clínicas, as diferenças de risco absoluto de 10 anos entre o grupo de alto e baixo risco foram de 6,9% para 11,2%, enquanto houve diferença de 18,7% de acordo com a classificação de EPClin35.
Conclusão
A utilização das assinaturas genômicas auxiliam de maneira substancial a decisão da terapia adjuvante. A plataforma OncotypeDx é recomendada para todos os tumores de mama T1 e T2 que apresentem receptor de estrogênio positivo com Her2 negativo com linfonodos negativos e o teste pode ser indicado ainda com linfonodos positivos (de 1 a 3), baseado em estudos retrospectivos. Com esta abordagem estima-se que 65% das pacientes que fizerem o teste não necessitarão de tratamento adjuvante com quimioterapia. E com os dados mais atuais devemos seguir a recomendação baseada no RS: para mulheres com idade acima de 50 anos RS menor que 25 não há benefício. Para mulheres com idade de 50 anos ou menos não há qualquer benefício com RS menor que 16. Para o RS entre 16 e 20 o benefício é de apenas 1,5% e deve ser discutido individualmente. Para RS entre 21 e 25 o benefício é de cerca de 7,0% e deve ser considerado o tratamento com quimioterapia. Já para pacientes com RS maior que 26, independentemente da idade, a quimioterapia deve ser oferecida com parte do tratamento (Figura 6). 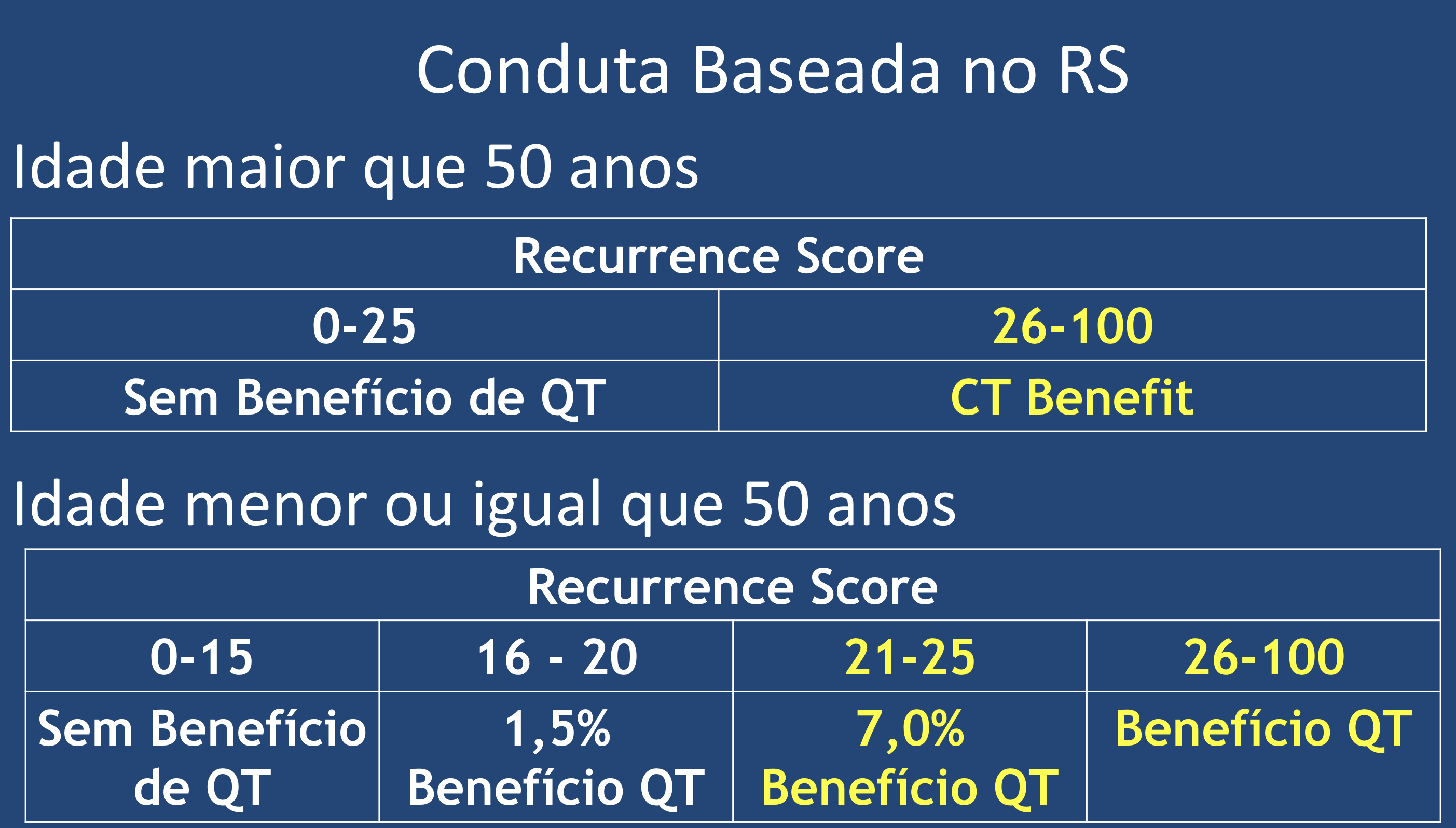
O Mammaprint pode ser utilizado em tumores de mama T1 e T2 receptores de estrógeno positivos com até 3 linfonodos comprometidos em que o risco clínico é considerado alto. A ferramenta de cálculo de risco utilizada no estudo MINDACT não está mais disponível on-line (Adjuvant!Online), porém uma tabela pode ser utilizada para este cálculo (Figura 7). 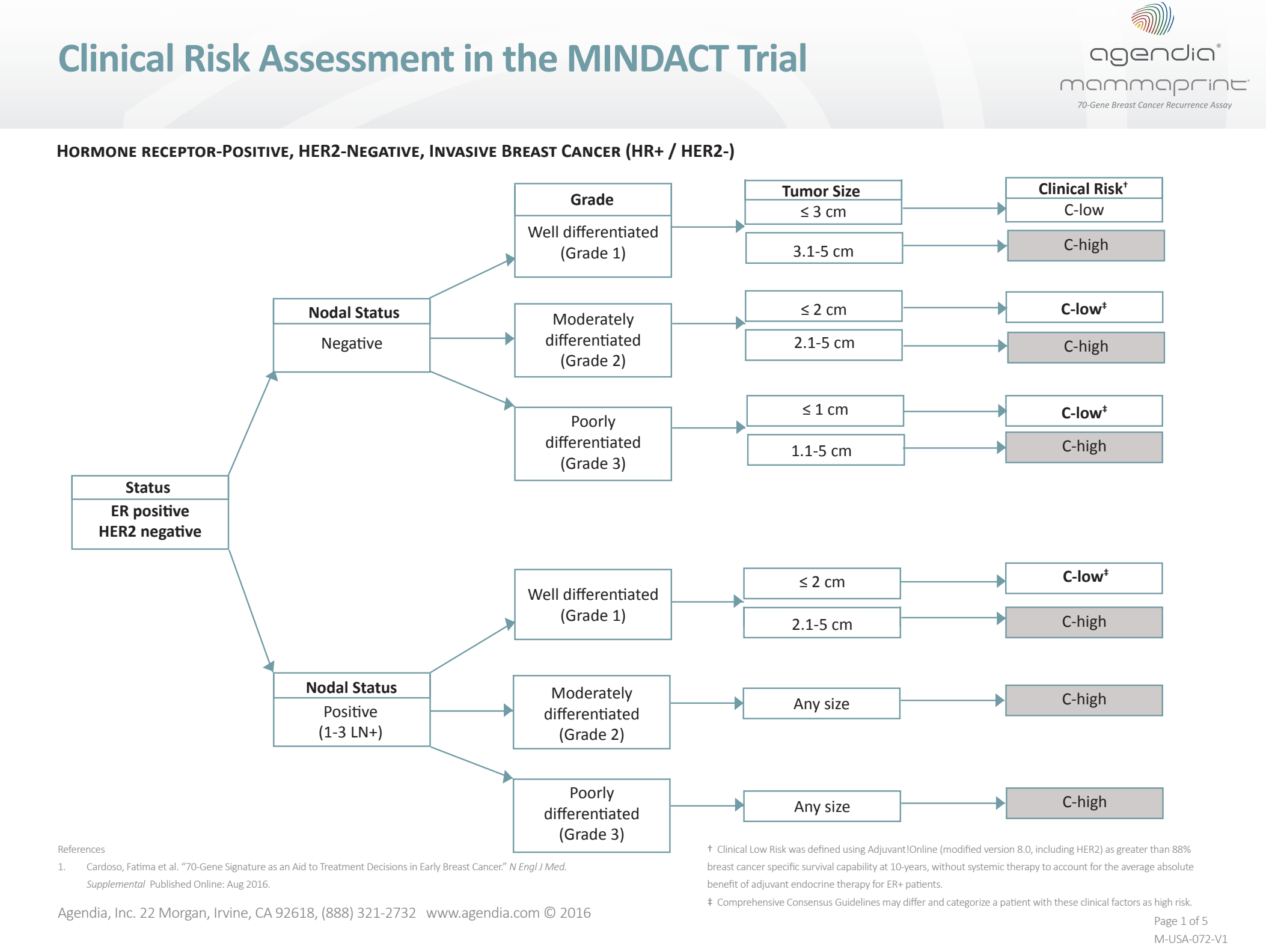
Pacientes com baixo risco não necessitariam de qualquer teste genômico, enquanto pacientes com alto risco clínico poderiam diminuir a indicação de quimioterapia em até 46%. Desta maneira, o OncotypeDx2 e o Mammaprint3 tornaram-se padrão para a escolha da terapia adjuvante e com o resultado compatível com baixo risco apenas a hormonioterapia seria indicada, enquanto que diante de um resultado de alto risco indicaríamos a quimioterapia seguida da terapia hormonal. Outras assinaturas, como Prosigna®4, EndoPredict®5, Breast Cancer Index6 podem ser usadas para quantificar risco de recorrência, mas ainda não estão validadas para auxiliar na escolha da terapia sistêmica a ser empregada7.
Por fim o custo destes testes ainda é elevado dificultando o acesso e limitando seu uso na prática diária. O momento da solicitação destes testes é fundamental, uma vez que a maioria das plataformas demora cerca de 3 a 4 semanas para o resultado final. A disseminação das informações a respeito da correta solicitação, bem como da conduta frente ao resultado, é fundamental para que o teste seja melhor aproveitado. Assim, a educação dos cirurgiões e dos oncologistas clínicos na abordagem dos casos é imprescindível.
Referências:
-
Mook S, Van't Veer LJ, Rutgers EJ, Piccart-Gebhart MJ, Cardoso F. Individualization of therapy using Mammaprint: from development to the MINDACT Trial. Cancer genomics & proteomics. 2007;4(3):147-55.
-
Sparano JA, Gray RJ, Makower DF, Pritchard KI, Albain KS, Hayes DF, et al. Prospective Validation of a 21-Gene Expression Assay in Breast Cancer. New England Journal of Medicine. 2015;373(21):2005-14.
-
Piccart M, Rutgers E, van’ t Veer L, Slaets L, Delaloge S, Viale G, et al. Abstract CT039: Primary analysis of the EORTC 10041/ BIG 3-04 MINDACT study: a prospective, randomized study evaluating the clinical utility of the 70-gene signature (MammaPrint) combined with common clinical-pathological criteria for selection of patients for adjuvant chemotherapy in breast cancer with 0 to 3 positive nodes. Cancer Research. 2016;76(14 Supplement):CT039.
-
Dowsett M, Sestak I, Lopez-Knowles E, Sidhu K, Dunbier AK, Cowens JW, et al. Comparison of PAM50 risk of recurrence score with oncotype DX and IHC4 for predicting risk of distant recurrence after endocrine therapy. Journal of clinical oncology : official journal of the American Society of Clinical Oncology. 2013;31(22):2783-90.
-
Dubsky P, Filipits M, Jakesz R, Rudas M, Singer CF, Greil R, et al. EndoPredict improves the prognostic classification derived from common clinical guidelines in ER-positive, HER2-negative early breast cancer. Annals of oncology : official journal of the European Society for Medical Oncology. 2013;24(3):640-7.
-
Sgroi DC, Sestak I, Cuzick J, Zhang Y, Schnabel CA, Schroeder B, et al. Prediction of late distant recurrence in patients with oestrogen-receptor-positive breast cancer: a prospective comparison of the breast-cancer index (BCI) assay, 21-gene recurrence score, and IHC4 in the TransATAC study population. The Lancet Oncology. 2013;14(11):1067-76.
-
Sestak I, Buus R, Cuzick J, Dubsky P, Kronenwett R, Ferree S, et al. Abstract S6-05: Comprehensive comparison of prognostic signatures for breast cancer in TransATAC2017. S6-05 p.
-
Goldhirsch A, Wood WC, Coates AS, Gelber RD, Thurlimann B, Senn HJ. Strategies for subtypes--dealing with the diversity of breast cancer: highlights of the St. Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2011. Annals of oncology : official journal of the European Society for Medical Oncology. 2011;22(8):1736-47.
-
Simon R. Development and Validation of Therapeutically Relevant Multi-Gene Biomarker Classifiers. JNCI: Journal of the National Cancer Institute. 2005;97(12):866-7.
-
Paik S, Shak S, Tang G, Kim C, Baker J, Cronin M, et al. A Multigene Assay to Predict Recurrence of Tamoxifen-Treated, Node-Negative Breast Cancer. 2004;351(27):2817-26.
-
Tang G, Cuzick J, Costantino JP, Dowsett M, Forbes JF, Crager M, et al. Risk of recurrence and chemotherapy benefit for patients with node-negative, estrogen receptor-positive breast cancer: recurrence score alone and integrated with pathologic and clinical factors. Journal of clinical oncology : official journal of the American Society of Clinical Oncology. 2011;29(33):4365-72.
-
Cuzick J, Sestak I, Baum M, Buzdar A, Howell A, Dowsett M, et al. Effect of anastrozole and tamoxifen as adjuvant treatment for early-stage breast cancer: 10-year analysis of the ATAC trial. The Lancet Oncology. 2010;11(12):1135-41.
-
Dowsett M, Cuzick J, Wale C, Forbes J, Mallon EA, Salter J, et al. Prediction of risk of distant recurrence using the 21-gene recurrence score in node-negative and node-positive postmenopausal patients with breast cancer treated with anastrozole or tamoxifen: a TransATAC study. Journal of clinical oncology : official journal of the American Society of Clinical Oncology. 2010;28(11):1829-34.
-
Forbes JF, Cuzick J, Buzdar A, Howell A, Tobias JS, Baum M. Effect of anastrozole and tamoxifen as adjuvant treatment for early-stage breast cancer: 100-month analysis of the ATAC trial. The Lancet Oncology. 2008;9(1):45-53.
-
Habel LA, Shak S, Jacobs MK, Capra A, Alexander C, Pho M, et al. A population-based study of tumor gene expression and risk of breast cancer death among lymph node-negative patients. Breast cancer research : BCR. 2006;8(3):R25.
-
Gianni L, Zambetti M, Clark K, Baker J, Cronin M, Wu J, et al. Gene expression profiles in paraffin-embedded core biopsy tissue predict response to chemotherapy in women with locally advanced breast cancer. Journal of clinical oncology : official journal of the American Society of Clinical Oncology. 2005;23(29):7265-77.
-
Paik S, Tang G, Shak S, Kim C, Baker J, Kim W, et al. Gene expression and benefit of chemotherapy in women with node-negative, estrogen receptor-positive breast cancer. Journal of clinical oncology : official journal of the American Society of Clinical Oncology. 2006;24(23):3726-34.
-
Albain KS, Barlow WE, Ravdin PM, Farrar WB, Burton GV, Ketchel SJ, et al. Adjuvant chemotherapy and timing of tamoxifen in postmenopausal patients with endocrine-responsive, node-positive breast cancer: a phase 3, open-label, randomised controlled trial. Lancet (London, England). 2009;374(9707):2055-63.
-
Albain KS, Barlow WE, Shak S, Hortobagyi GN, Livingston RB, Yeh IT, et al. Prognostic and predictive value of the 21-gene recurrence score assay in postmenopausal women with node-positive, oestrogen-receptor-positive breast cancer on chemotherapy: a retrospective analysis of a randomised trial. The Lancet Oncology. 2010;11(1):55-65.
-
Sparano JA, Gray RJ, Makower DF, Pritchard KI, Albain KS, Hayes DF, et al. Adjuvant Chemotherapy Guided by a 21-Gene Expression Assay in Breast Cancer. 2018;379(2):111-21.
-
Harris L, Fritsche H, Mennel R, Norton L, Ravdin P, Taube S, et al. American Society of Clinical Oncology 2007 update of recommendations for the use of tumor markers in breast cancer. Journal of clinical oncology : official journal of the American Society of Clinical Oncology. 2007;25(33):5287-312.
-
van de Vijver MJ, He YD, van 't Veer LJ, Dai H, Hart AAM, Voskuil DW, et al. A Gene-Expression Signature as a Predictor of Survival in Breast Cancer. 2002;347(25):1999-2009.
-
Buyse M, Loi S, van't Veer L, Viale G, Delorenzi M, Glas AM, et al. Validation and clinical utility of a 70-gene prognostic signature for women with node-negative breast cancer. Journal of the National Cancer Institute. 2006;98(17):1183-92.
-
Mook S, Schmidt MK, Weigelt B, Kreike B, Eekhout I, van de Vijver MJ, et al. The 70-gene prognosis signature predicts early metastasis in breast cancer patients between 55 and 70 years of age. Annals of oncology : official journal of the European Society for Medical Oncology. 2010;21(4):717-22.
-
Mook S, Schmidt MK, Viale G, Pruneri G, Eekhout I, Floore A, et al. The 70-gene prognosis-signature predicts disease outcome in breast cancer patients with 1-3 positive lymph nodes in an independent validation study. Breast cancer research and treatment. 2009;116(2):295-302.
-
Glas AM, Floore A, Delahaye LJ, Witteveen AT, Pover RC, Bakx N, et al. Converting a breast cancer microarray signature into a high-throughput diagnostic test. BMC genomics. 2006;7:278.
-
Cardoso F, van’t Veer LJ, Bogaerts J, Slaets L, Viale G, Delaloge S, et al. 70-Gene Signature as an Aid to Treatment Decisions in Early-Stage Breast Cancer. 2016;375(8):717-29.
-
Cardoso F, van't Veer LJ, Bogaerts J, Slaets L, Viale G, Delaloge S, et al. 70-Gene Signature as an Aid to Treatment Decisions in Early-Stage Breast Cancer. The New England journal of medicine. 2016;375(8):717-29.
-
Ma XJ, Salunga R, Dahiya S, Wang W, Carney E, Durbecq V, et al. A five-gene molecular grade index and HOXB13:IL17BR are complementary prognostic factors in early stage breast cancer. Clinical cancer research : an official journal of the American Association for Cancer Research. 2008;14(9):2601-8.
-
Ma XJ, Wang Z, Ryan PD, Isakoff SJ, Barmettler A, Fuller A, et al. A two-gene expression ratio predicts clinical outcome in breast cancer patients treated with tamoxifen. Cancer cell. 2004;5(6):607-16.
-
Jerevall PL, Ma XJ, Li H, Salunga R, Kesty NC, Erlander MG, et al. Prognostic utility of HOXB13:IL17BR and molecular grade index in early-stage breast cancer patients from the Stockholm trial. British journal of cancer. 2011;104(11):1762-9.
-
Sgroi DC, Sestak I, Cuzick J, Zhang Y, Schnabel C, Erlander MG, et al. Comparative Performance of Breast Cancer Index (BCI) vs. Oncotype Dx and IHC4 in the Prediction of Late Recurrence in Hormonal Receptor-Positive Lymph Node-Negative Breast Cancer Patients: A TransATAC Study2012. S1-9 p.
-
Filipits M, Nielsen TO, Rudas M, Greil R, Stoger H, Jakesz R, et al. The PAM50 risk-of-recurrence score predicts risk for late distant recurrence after endocrine therapy in postmenopausal women with endocrine-responsive early breast cancer. Clinical cancer research : an official journal of the American Association for Cancer Research. 2014;20(5):1298-305.
-
Filipits M, Rudas M, Jakesz R, Dubsky P, Fitzal F, Singer CF, et al. A new molecular predictor of distant recurrence in ER-positive, HER2-negative breast cancer adds independent information to conventional clinical risk factors. Clinical cancer research : an official journal of the American Association for Cancer Research. 2011;17(18):6012-20.
-
Dubsky P, Filipits M, Jakesz R, Rudas M, Singer CF, Greil R, et al. EndoPredict improves the prognostic classification derived from common clinical guidelines in ER-positive, HER2-negative early breast cancer2012.
- Votes: (0%)
- Votes: (0%)
- Votes: (0%)