Bottom line
O intestino humano abriga uma microbiota diversificada e complexa, que contribui para a homeostase geral do hospedeiro. É crescente o reconhecimento de que a microbiota intestinal tem um papel importante em doenças humanas, como doenças inflamatórias intestinais, obesidade e câncer, incluindo colorretal (CCR). Os mecanismos bacterianos que parecem contribuir para o CCR são complexos e não totalmente compreendidos, mas evidências crescentes sugerem uma associação entre a microbiota intestinal, e a carcinogênese colorretal. A microbiota intestinal interage com fatores presentes na mucosa intestinal, promovendo inflamação crônica e transformação maligna por influência direta na fisiologia das células intestinais do hospedeiro. Neste artigo, iremos abordar os principais tópicos relacionados ao papel da microbiota no câncer colorretal e seu impacto clínico.  José Guilherme Datorre é biólogo, Estudante de mestrado no Hospital de Amor de Barretos Fundação PIO XII e membro do Centro de Pesquisa em Oncologia Molecular
José Guilherme Datorre é biólogo, Estudante de mestrado no Hospital de Amor de Barretos Fundação PIO XII e membro do Centro de Pesquisa em Oncologia Molecular
Autores: José Guilherme Datorre1, Ana Carolina de Carvalho1, Denise Guimarães1,2 e Rui Manuel Reis1.
1Centro de Pesquisa em Oncologia Molecular; 2Departamento de Prevenção, Hospital de Câncer de Barretos, Brasil.
Abstract: A microbiota é vital para a saúde humana, pois molda o sistema imunológico, mantém a homeostase epitelial, produz vitaminas e exclui potenciais patógenos. A diversidade e abundância de espécies que compõem a microbiota de um indivíduo podem modular positivamente ou negativamente a susceptibilidade ao desenvolvimento de câncer. A atribuição de um papel causal no câncer a microrganismos específicos, as interações entre hospedeiro-microbiota e a exposição a fatores ambientais na carcinogênese são tópicos que tem sido explorados na busca por biomarcadores de diagnóstico, prognóstico e tratamento de câncer. A relação entre câncer e microbiota é complexa e acredita-se que os microrganismos estejam envolvidos em ~20% das malignidades humanas. Um dos sítios tumorais mais explorados em relação a esta associação é o câncer colorretal (CCR). O CCR é atualmente o segundo tipo de câncer mais prevalente no Brasil (excluindo os de pele não melanoma) e terceiro em todo o mundo. O microambiente tumoral, incluindo fatores genéticos, inflamação e dieta, pode influenciar a maneira como as células do cólon respondem à presença de certas bactérias. A progressão tumoral pode ser suprimida (por bactérias probióticas) ou promovida (por bactérias patogênicas) como resultado de mudanças na composição da microbiota intestinal. A Fusobacterium nucleatum (Fn) tem se destacado como uma importante bactéria patogênica presente no tecido tumoral de pacientes com câncer colorretal. Sua presença tem sido associada a importantes características clínicas, moleculares e indicadores de pior prognóstico e de maior agressividade tumoral nestes pacientes. Diversas hipóteses têm sido levantadas sobre o papel da Fn na carcinogênese colorretal, com a colonização por Fn sendo uma causa (driver) ou uma consequência (passenger) do CCR. Faz-se então importante a estratificação com base no microbioma intestinal, como um novo biomarcador tumoral para auxiliar no manejo clínico do CCR.
Palavras-chave: microbiota; microbioma, câncer colorretal, carcinoma colorretal, fusobacterium nucleatum, homeostase intestinal, disbiose
Introdução
Microbiota e câncer
As tecnologias de sequenciamento em larga escala têm possibilitado avanços extraordinários não só no conhecimento do genoma humano e do câncer, mas também tem desvendado a abundância e diversidade da microbiota no contexto normal e neoplásico. O grande desafio atual é traduzir esta avalanche de dados, em conhecimento, e sua aplicação prática no âmbito da medicina personalizada, com o intuito de melhorar a prevenção, diagnóstico e tratamento oncológico1,2.
A microbiota humana consiste no conjunto de bactérias e outros microrganismos (vírus, fungos e protozoários) que habitam a superfície das barreiras epiteliais do corpo humano, como as mucosas1,2. Os microrganismos que compõem a microbiota afetam funções fisiológicas importantes como o metabolismo, funções neurológicas e cognitivas, hematopoiese, inflamação e a imunidade, tanto no local onde estão aderidos ou a distância como uma consequência da infecção patológica1,2. A saúde do hospedeiro depende da manutenção de barreiras epiteliais nas quais a microbiota se fixa e com a qual mantem um equilíbrio3. A disbiose intestinal, alteração na composição da microbiota onde há um aumento na prevalência de bactérias prejudiciais e diminuição de bactérias protetoras, interrompe o equilíbrio e interação fisiológica entre o tecido intestinal e os microrganismos ali existentes, resultando na quebra destas barreiras e induzindo reações inflamatórias que podem contribuir para a iniciação e progressão tumoral4,5 (Figura 1).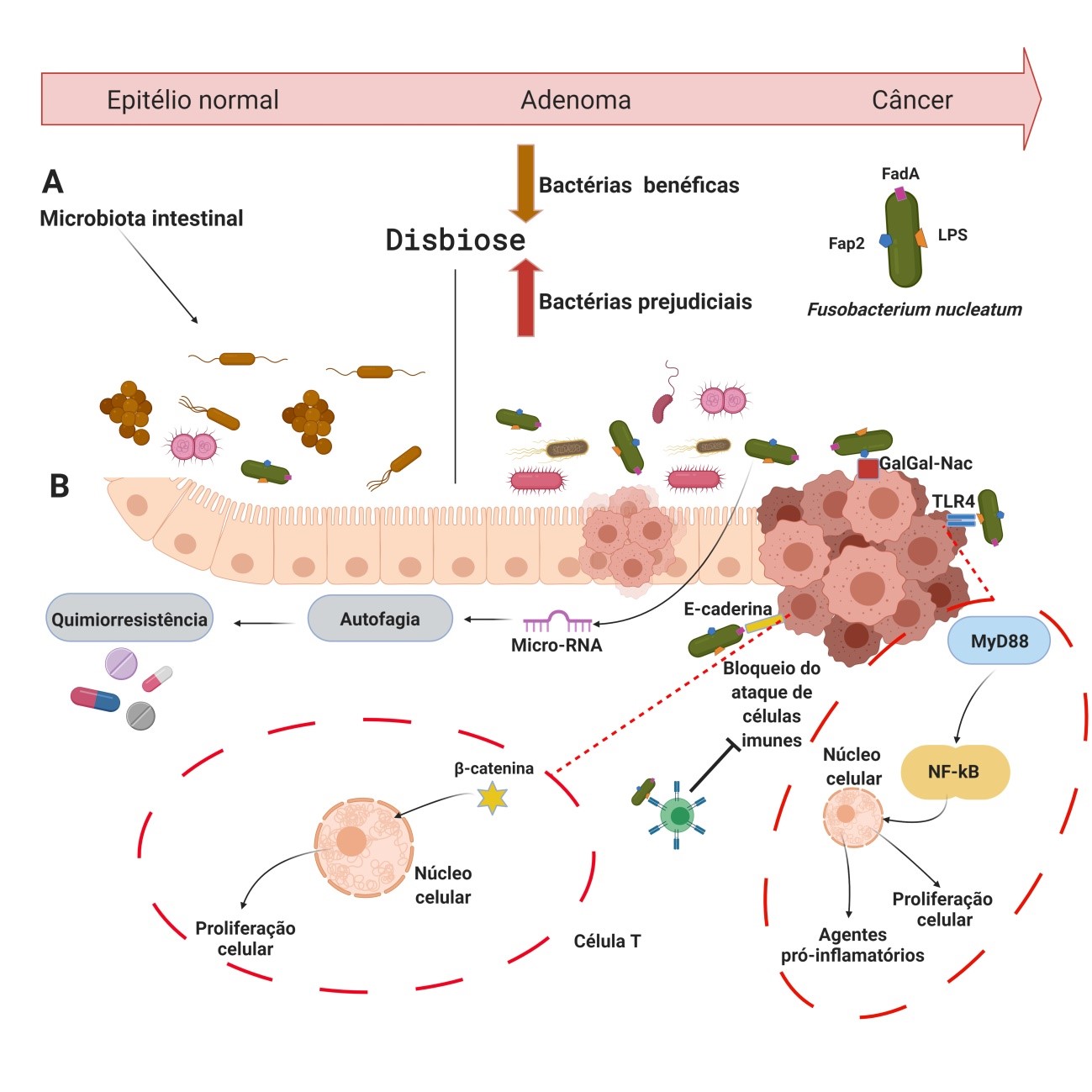 Figura 1: Disbiose e potenciais mecanismos de Fn no CCR. (A) Epitélio saudável da mucosa colorretal, a maioria das bactérias endógenas em adultos desempenha um papel benéfico, de proteção, contribuindo para o metabolismo, absorção de nutrientes e ajudando a manter a estrutura e a função imunológica (seta marrom). Foi demonstrado que várias espécies bacterianas têm propriedades pró-inflamatórias e pró-carcinogênicas, que podem consequentemente ter um impacto na carcinogênese colorretal (seta vermelha). A mucosa intestinal de pacientes com CCR pode ser colonizada por um ou vários micróbios com propriedades pró-carcinogênicas, como produção de compostos prejudiciais ao DNA, indução da proliferação celular, causando permeabilização da barreira intestinal e indução de inflamação crônica, levando ao início da CCR. (B) Biomoléculas (LPS, FadA e Fap2) estão localizadas na superfície de Fn. LPS quebra a mucosa da barreira intestinal e facilita o contato de Fn com as células epiteliais. F. nucleatum pode se ligar diretamente através de Fap2 a Gal-GalNAc que é superexpressa em células de CCR. E através de FadA ela ativa MYD88 por TLR4, que posteriormente ativa a cascata pró-inflamatória NF-kB, tornando o microambiente tumoral propício para a ocorrência de CCR. FadA ativa a via de sinalização E-caderina/β-catenina, que também contribui para a proliferação de células tumorais. F. nucleatum também pode bloquear a ação de células do sistema imune e modular a autofagia das células epiteliais intestinais ativando microRNAs reguladores, que estão correlacionados com mecanismos de quimiorresistência a quimioterápicos.
Figura 1: Disbiose e potenciais mecanismos de Fn no CCR. (A) Epitélio saudável da mucosa colorretal, a maioria das bactérias endógenas em adultos desempenha um papel benéfico, de proteção, contribuindo para o metabolismo, absorção de nutrientes e ajudando a manter a estrutura e a função imunológica (seta marrom). Foi demonstrado que várias espécies bacterianas têm propriedades pró-inflamatórias e pró-carcinogênicas, que podem consequentemente ter um impacto na carcinogênese colorretal (seta vermelha). A mucosa intestinal de pacientes com CCR pode ser colonizada por um ou vários micróbios com propriedades pró-carcinogênicas, como produção de compostos prejudiciais ao DNA, indução da proliferação celular, causando permeabilização da barreira intestinal e indução de inflamação crônica, levando ao início da CCR. (B) Biomoléculas (LPS, FadA e Fap2) estão localizadas na superfície de Fn. LPS quebra a mucosa da barreira intestinal e facilita o contato de Fn com as células epiteliais. F. nucleatum pode se ligar diretamente através de Fap2 a Gal-GalNAc que é superexpressa em células de CCR. E através de FadA ela ativa MYD88 por TLR4, que posteriormente ativa a cascata pró-inflamatória NF-kB, tornando o microambiente tumoral propício para a ocorrência de CCR. FadA ativa a via de sinalização E-caderina/β-catenina, que também contribui para a proliferação de células tumorais. F. nucleatum também pode bloquear a ação de células do sistema imune e modular a autofagia das células epiteliais intestinais ativando microRNAs reguladores, que estão correlacionados com mecanismos de quimiorresistência a quimioterápicos.
A etiologia do câncer é complexa, e, além dos fatores genéticos e ambientais, sabe-se que os microrganismos estão envolvidos em cerca de 20% das neoplasias humanas6. Dos 3,7 × 1030 microrganismos estimados que habitam a Terra, apenas 10 são designados pela International Agency for Research on Cancer (IARC) como carcinogênicos para seres humanos6. A maioria desses microrganismos carcinogênicos coloniza grande parcela da população humana, mas apenas uma pequena fração de indivíduos infectados desenvolverá câncer6. Os mecanismos pelos quais a microbiota contribue para a carcinogênese, se enquadram em três grandes categorias: (i) alteração do equilíbrio da proliferação e morte das células hospedeiras; (ii) interferência na função do sistema imunológico; e (iii) influência no metabolismo do hospedeiro (ex: metabolismo de alimentos e fármacos)4-6
Microbiota e câncer colorretal
O câncer colorretal (CCR) é o terceiro tipo de câncer mais prevalente em todo o mundo. Os fatores etiológicos já bem estabelecidos para CCR são: idade avançada (> 50 anos), histórico pessoal de câncer colorretal ou pólipos, doença inflamatória intestinal, predisposição genética, dieta pobre em fibras e alta em gorduras e carne vermelha, sedentarismo, diabetes, obesidade, tabagismo e álcool21.
O trato gastrointestinal é densamente povoado por microrganismos. A microbiota intestinal compreende aproximadamente 3 × 1013 células bacterianas6. Ao interagir com as células epiteliais intestinais do hospedeiro, a microbiota intestinal regula as funções de barreira e a homeostase da mucosa intestinal5, garantindo a simbiose da microbiota do hospedeiro, prevenindo a infecção por patógenos, controlando o crescimento excessivo de bactérias que residem na porção distal do cólon e reto (denominadas patobiontes), e que tem o potencial de causar doenças7. Além disso, auxiliam na metabolização da fibra alimentar indigerível e na síntese de vitaminas e regulação do metabolismo4,7. Um epitélio intestinal preservado e funcional mantém um corpo saudável, e a homeostase epitelial intestinal é mantida por interferência contínua entre a microbiota intestinal, as células imunes e a mucosa que forma a barreira2,5.
A composição da microbiota é modelada pela genética do hospedeiro, colonização no momento do nascimento, tipo de parto, estilo de vida, dieta alimentar, incidência de doenças e exposição a antibióticos8. A composição da microbiota evolui durante os primeiros anos de vida até a fase adulta, onde sua composição no intestino e em outras barreiras epiteliais permanece relativamente constante, embora ainda possa ser afetada pelos fatores acima mencionados9.
Os efeitos da microbiota intestinal na susceptibilidade ao CCR têm sido investigados desde a década de 1960. Neste período, vários trabalhos sobre a carcinogênese induzida quimicamente em modelos animais, demonstraram que em ratos livre de germes, o desenvolvimento de tumores era significativamente menor do que em ratos com germes10,11,. Trabalhos subsequentes identificaram alguns dos principais gêneros associados à carcinogênese colorretal, tais como Escherichia, Enterococcus, Bacteroides e Clostridium,12.
Posteriormente, estudos em humanos demonstram que a microbiota intestinal relacionada ao CCR é diferente da microbiota intestinal de indivíduos saudáveis1-5 .Na microbiota do CCR há maior riqueza de espécies, menor abundância de táxons potencialmente protetores com papel importante na imunoregulação e metabolismo (por exemplo, Roseburia), e aumento da abundância de táxons procarcinogênicos (como Bacteroides, Escherichia, Fusobacterium e Porphyromonas)12 Esses dados forneceram evidências da importância funcional da comunidade microbiana na carcinogênese, e identificam um conjunto principal de microorganismos que podem ser potencialmente carcinogênicos (Figura 1). Importante estudo de metagenômica, evidenciou que o microbioma intestinal no CCR apresenta maior riqueza do que controles saudáveis, parcialmente devido às expansões de espécies tipicamente derivadas da cavidade oral. Este microbioma associado com o câncer apresentou importante valor prognóstico para o CCR auxiliando em seu manejo clínico13.
Fusobacterium nucleatum: causa ou consequência do câncer colorretal?
Nos últimos 10 anos, várias espécies de bactérias têm chamado atenção por seus possíveis papéis na carcinogênese colorretal, com especial ênfase na espécie Fusobacterium nucleatum14,15. F. nucleatum é uma bactéria anaeróbica gram-negativa, presente comumente na mucosa bucal humana, porém pode ser encontrada também no trato gastrointestinal e em outras partes do corpo15. É considerada um patógeno oportunista, com papel já bem estabelecido nas infecções orais15. O principal meio de deslocamento desta bactéria para outras partes do corpo (como para o intestino) se dá por deglutição e/ou via hematogênica, aderida ou não a células epiteliais, encontrando um microambiente favorável para seu desenvolvimento, levando ao surgimento de infecções intestinais, até o CCR16,17.
Descobriu-se que a F. nucleatum expressa proteínas que facilitam a sua adesão às células epiteliais, tais como a Fap2 que se liga à Gal-GalNAc (frequentemente super expressa nas células de CCR), e a FadA que se liga à E-caderina das células epiteliais intestinais18 (Figura 1B). Assim, F. nucleatum a coloniza seletivamente células do tecido de CCR, ativando a via β-catenina e levando ao crescimento celular descontrolado. Outras moléculas, como lipopolissacarídeos (LPS) também encontradas na superfície de F. Nucleatum contribuem para a colonização, pois rompem a barreira intestinal e facilitam sua entrada nas células epiteliais18(Figura 1B).
Alguns estudos relataram a presença aumentada de Fusobacterium somente no câncer e não em lesões precursoras, como o adenoma, sugerindo um papel passenger, promovendo somente a progressão do câncer19. No entanto, um inúmero conjunto de evidências sugere que o gênero Fusobacterium, e em especial a espécie Fusobacterium nucleatum, desempenha um papel oncogênico (driver), contribuindo para o desenvolvimento e progressão do câncer colorretal. Vários estudos populacionais têm evidenciado a presença e expressão aumentada de F. nucleatum em tecido tumoral em comparação com tecido normal de pacientes com CCR. Também tem sido demonstrado o enriquecimento de F. nucleatum em amostras de adenomas colorretais humanos em comparação com tecido saudável19, assim como em amostras fecais de pessoas diagnosticadas com CCR e/ou adenomas em comparação com controles saudáveis20. Estes dados têm contribuído para a consolidação da F. nucleatum como importante fator etiológico em CCR. A presença da F. nucleatum em CCR também tem sido associada a várias características clínico-patológicas e moleculares, como localização no cólon proximal, estadios mais avançados da doença, instabilidade de microssatélites (MSI), fenótipo metilador de ilhas CpG, mutações no oncogene BRAF e menor densidade de células T no microambiente tumoral, causando deficiência do sistema imune15,22(Figura 1B). Por último, vários estudos têm confirmado o seu papel como importante fator prognóstico em CCR, estando a sua presença associada a pior prognóstico, maior risco de metástases e menor sobrevida global22,23.
A Fusobacterium nucleatum pode influenciar a resposta à terapia, promovendo a quimiorresistência de CCR à oxaliplatina e 5-fluorouracil (5-FU) através de um mecanismo dependente de TLR4 / MYD8824, Fn também sinaliza microRNAs específicos para ativação da autofagia que levam a quimiorresitência interferindo no tratamento do CCR24 (Figura 1B). Estas associações têm sido corroboradas por estudos experimentais. Em linhagens celulares a F. nucleatum promove a proliferação de células de CCR, e em modelos animais a presença de F. nucleatum em xenoenxertos de CCR aumenta as taxas de crescimento tumoral25.
Microbiota e câncer colorretal na população brasileira
Conhecida a relevância da microbiota intestinal no CCR, o Centro de Pesquisa em Oncologia Molecular do Hospital de Câncer de Barretos tem explorado o papel da microbiota em pacientes brasileiros.
O trabalho inicial teve como objetivo comparar a riqueza e a abundância da comunidade microbiana de amostras tumorais de CCR com a mucosa normal através de sequenciamento de nova geração (NGS)22. Corroborando a literatura internacional, identificamos um microbioma distinto no tumor, com destaque para o gênero Fusobacterium (Figura 2).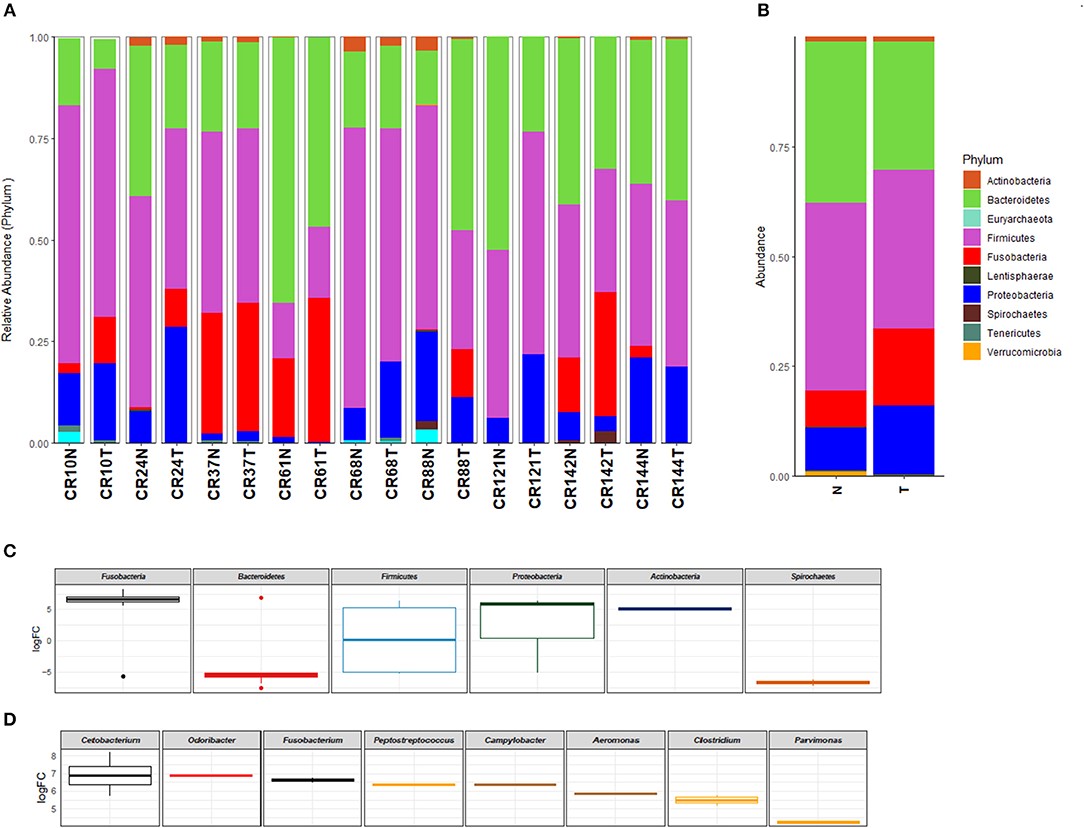
Figura 2: Perfil taxonômico da microbiota em nível de filo identificado no carcinoma colorretal e no tecido normal adjacente pareado (A) e agrupados por tipo de amostra (tumor vs. normal) (B). Fonte: https://doi.org/10.3389/fonc.2019.00813
Em seguida, validamos os achados avaliando a presença de F. nucleatum por PCR em tempo-real em uma série de mais de 150 tumores. Além de confirmar taxas mais altas desta bactéria em amostras de tumor, também observamos associações com importantes características dos pacientes, tais como localização proximal, mutação BRAF, presença de MSI22. Verificamos ainda o seu significante papel prognóstico, estando a presença de F. nucleaum associada a uma pior sobrevida câncer-específica e sobrevida global dos pacientes22 (Figura 3).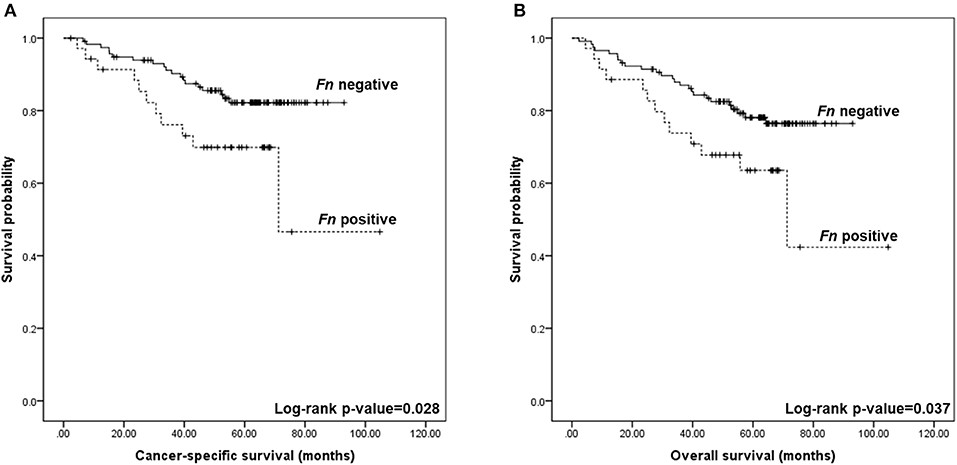
Figura 3: Curvas de Kaplan – Meier para sobrevida global e específica do câncer colorretal, de acordo com a detecção do DNA de Fusobacterium nucleatum no tecido de câncer colorretal. (A) A sobrevida específica de câncer em cinco anos foi de 69,9% para F. nucleatum positivo e 82,2% para negativo (log-rank p = 0,028). (B) A sobrevida global em cinco anos foi de 63,5% para F. nucleatum positivo e 76,5% para negativo (log-rank p = 0,037). Fonte: https://doi.org/10.3389/fonc.2019.00813
Perspectivas futuras
Além das possíveis aplicações descritas, como um indicador de prognóstico, o nosso grupo está desenvolvendo metodologias mais sensíveis para detecção de F. nucleatum e tem explorado o seu papel no rastreamento e detecção precoce de CCR. A quantificação de DNA de F. nucleatum em fezes pode servir como um biomarcador promissor para detecção de CCR ou de indivíduos com lesões pré-malignas, como adenomas. Neste contexto, amostras de material fecal coletadas de participantes do rastreamento do câncer colorretal com FIT (teste imunoquímico de sangue oculto nas fezes) anual podem ser usadas para monitorar mudanças na microbiota, tornando possível detectar um maior risco de presença de lesões colorretais potencialmente malignas26. Como o FIT é amplamente utilizado para rastreamento de CCR, e testes moleculares baseados em fezes têm excelentes perspectivas como uma futura ferramenta de triagem para aumentar a detecção de CCR e lesões precursoras, estudos futuros podem validar métodos de rastreamento baseados em organismos componentes da microbiota como Fusobacterium nucleatum no câncer colorretal27,28.
O papel da microbiota intestinal e sua relação com a carcinogênese também oferecem uma oportunidade de explorar novas aplicações terapêuticas em oncologia. Recentemente, o transplante fecal de microbiota, procedimento no qual as fezes de um doador saudável são coletadas, misturadas a uma solução, coadas e colocadas no intestino do paciente receptor, seja por colonoscopia, endoscopia ou enema, tem sido utilizado como método mais direto para alterar a composição da microbiota intestinal. Recentes trabalhos têm revelado o potencial desta técnica no tratamento de vários tumores relacionados à disbiose intestinal e de complicações associadas ao tratamento do câncer, melhorando o prognóstico do paciente29.
Conclusão
As bactérias existentes na mucosa gastrointestinal influenciam o desenvolvimento e progressão do CCR. No entanto, sua contribuição para a carcinogênese é complexa e ainda pouco elucidada. As intensas pesquisas em andamento permitirão entender os mecanismos associados à carcinogênese bacteriana, e certamente levar à identificação de biomarcadores microbianos com relevância clínica, abrindo novos caminhos no rastreamento, diagnóstico e tratamento do CCR.
Referências
1 - Sugimoto, Yuki, et al. "A metagenomic strategy for harnessing the chemical repertoire of the human microbiome." Science366.6471 (2019).
2 - Nishida, Alex H., and Howard Ochman. "A great-ape view of the gut microbiome." Nature Reviews Genetics20.4 (2019): 195-206.
3 - Dzutsev, A., Goldszmid, R. S., Viaud, S., Zitvogel, L. & Trinchieri, G. “The role of the microbiota in inflammation, carcinogenesis, and cancer therapy.” Eur. J. Immunol. 45, 17–31 (2015).
4 - Huh, Jun R., and Henrique Veiga-Fernandes. "Neuroimmune circuits in inter-organ communication." Nature Reviews Immunology(2019): 1-12.
5 - Jobin, C. Colorectal cancer: CRC — all about microbial products and barrier function. Nat. Rev. Gastroenterol. Hepatol. 9, 694–696 (2012).
6 - De Martel, Catherine, et al. "Global burden of cancers attributable to infections in 2008: a review and synthetic analysis." The lancet oncology13.6 (2012): 607-615.
7 - Chung, W. S. F. et al. “Modulation of the human gut microbiota by dietary fibres occurs at the species level.” BMC Biol. 14, 3 (2016).
8 - Backhed, F. et al. “Dynamics and stabilization of the human gut microbiome during the first year of life.” Cell Host Microbe 17, 690–703 (2015).
9 - Faith, J. J. et al. “The long-term stability of the human gut microbiota.” Science 341, 1237439 (2013).
10 - Laqueur, G. L., McDaniel, E. G. & Matsumoto, H. “Tumor induction in germfree rats with methylazoxymethanol (MAM) and synthetic MAM acetate.” J. Natl Cancer Inst. 39, 355–371 (1967).
11 - Reddy, B. S. et al. “Colon carcinogenesis with azoxymethane and dimethylhydrazine in germ-free rats.” Cancer Res. 35, 287–290 (1975).
12 - Wong, Sunny H.; YU, Jun. “Gut microbiota in colorectal cancer: mechanisms of action and clinical applications.” Nature Reviews Gastroenterology & Hepatology, v. 16, n. 11, p. 690-704, (2019).
13 - Thomas, Andrew Maltez et al. “Metagenomic analysis of colorectal cancer datasets identifies cross-cohort microbial diagnostic signatures and a link with choline degradation.” Nature medicine, v. 25, n. 4, p. 667-678, (2019).
14 - Castellarin, Mauro, et al. "Fusobacterium nucleatum infection is prevalent in human colorectal carcinoma." Genome research22.2 (2012): 299-306
15 - Mima, Kosuke et al. “Fusobacterium nucleatum and T cells in colorectal carcinoma.” JAMA oncology, v. 1, n. 5, p. 653-661, (2015).
16 - Sears, Cynthia L., and Wendy S. Garrett. "Microbes, microbiota, and colon cancer." Cell host & microbe15.3 (2014): 317-328.
17 - McCoy, A.N. et al. (2013) Fusobacterium is associated with colorectal adenomas. PLoS One, 8, e53653.
18 - Casasanta, Michael A. et al. “Fusobacterium nucleatum host cell binding and invasion induces IL-8 and CXCL1 secretion that drives colorectal cancer cell migration.” bioRxiv, (2020).
19 - McCoy, A.N. et al. “Fusobacterium is associated with colorectal adenomas.” PLoS One, 8, e53653, (2013).
20 - Feng, Q. et al. “Gut microbiome development along the colorectal adenoma-carcinoma sequence.” Nat. Commun., 6, 6528 (2015).
21 - Kuipers, E., Grady, W., Lieberman, D. et al.“Colorectal cancer.” Nat Rev Dis Primers 1, 15065 (2015).
22 - De Carvalho, Ana Carolina et al. “Microbiota profile and impact of Fusobacterium nucleatum in colorectal cancer patients of Barretos Cancer Hospital.” Frontiers in oncology, v. 9, p. 813, (2019).
23 - Mima K, Nishihara R, Qian ZR, Cao Y, Sukawa Y, Nowak JA, et al. “Fusobacterium nucleatum in colorectal carcinoma tissue and patient prognosis.” Gut. 65(12):1973–80, (2016);.
24 - Yu T, Guo F, Yu Y, Sun T, Ma D, Han J, et al. Fusobacterium nucleatum promotes chemoresistance to colorectal cancer by modulating autophagy. Cell.;170(3):548–63.e16, (2017).
25 - Brennan, Caitlin A.; GARRETT, Wendy S. “Fusobacterium nucleatum—symbiont, opportunist and oncobacterium.” Nature Reviews Microbiology, v. 17, n. 3, p. 156-166, (2019).
26 - Zeller, G. et al. “Potential of fecal microbiota for early-stage detection of colorectal cancer.” Mol. Syst. Biol., 10, 766, (2014).
27 - Zackular, J.P. et al. “The human gut microbiome as a screening tool for colorectal cancer.” Cancer Prev. Res. (Phila.), 7, 1112–1121, (2014).
28 - Yu, J., et al. ”Metagenomic analysis of faecal microbiome as a tool towards targeted non-invasive biomarkers for colorectal cancer.” Gut. 66(1), 70–78, (2017).
29 - Chen, Danfeng, et al. "Fecal microbiota transplantation in cancer management: Current status and perspectives." International journal of cancer145.8 (2019): 2021-2031







