Análise primária do estudo de Fase 2 DESTINY-Lung02 demonstrou respostas robustas e duradouras do conjugado de anticorpo-medicamento trastuzumabe deruxtecana (Enhertu®, Daiichi-Sankyo/AstraZeneca) em pacientes com câncer de pulmão de células não pequenas não escamoso irressecável e/ou metastático com mutação HER2 (HER2m) previamente tratados. Os resultados foram apresentados no Congresso Mundial de Câncer de Pulmão (WCLC 2023) e publicados simultaneamente no Journal of Clinical Oncology (JCO)1.
No estudo DESTINY-Lung01 (Li et al. N Engl J Med 2022)2, trastuzumabe deruxtecana (T-DXd) na dose de 6,4 mg/kg a cada 3 semanas demonstrou respostas clinicamente significativas em pacientes com câncer de pulmão de células não pequenas (CPCNP) metastático HER2-mutante (HER2m; definido como variantes de nucleotídeo único e em sua maioria inserções no exon 20) previamente tratados.
Com mediana de duração do acompanhamento foi de 13,1 meses (variação de 0,7 a 29,1), a resposta objetiva confirmada centralmente ocorreu em 55% dos pacientes (95% IC, 44 a 65). A mediana de duração da resposta foi de 9,3 meses (95% IC, 5,7 a 14,7). A mediana de sobrevida livre de progressão foi de 8,2 meses (95% IC, 6,0 a 11,9) e a mediana de sobrevida global foi de 17,8 meses (95% IC, 13,8 a 22,1).
Eventos adversos relacionados ao medicamento de grau 3 ou superior ocorreram em 46% dos pacientes, sendo o evento mais comum a neutropenia (em 19%). Doença pulmonar intersticial relacionada ao tratamento ocorreu em 26% dos pacientes, sendo grau 5 em 2 pacientes.
“No DESTINY-Lung01, o resultado foi muito interessante, com 55% de resposta em pacientes politratados2. A grande questão foi a toxicidade. Será que com uma dose menor não haveria manutenção do benefício, às custas de menor toxicidade? Foi justamente essa a pergunta que o estudo DESTINY-LungL02 buscou responder”, afirmou o oncologista Pedro De Marchi, Coordenador Médico do Instituto Oncoclínicas.
DESTINY-Lung02
O DESTINY-Lung02 (NCT04644237), um estudo cego, multicêntrico, de fase II, investigou T-DXd nas doses de 5,4 mg/kg ou 6,4 mg/kg uma vez a cada 3 semanas em pacientes com CPCNP metastático HER2m previamente tratados (terapia contendo platina)1. Os resultados interinos mostraram atividade clinicamente significativa de T-DXd nesta população de pacientes nas duas dosagens, e esses dados, juntamente com os dados do DESTINY-Lung01, levaram à aprovação acelerada de T-DXd 5,4 mg/kg nessa população de pacientes no Estados Unidos3. Agora, no WCLC 2023, foram apresentados os resultados da análise primária do DESTINY-Lung021.
O desfecho primário foi a taxa de resposta objetiva (ORR) confirmada de acordo com RECIST v1.1 por revisão central independente e cega. Os principais desfechos secundários incluíram duração da resposta (DoR), taxa de controle da doença (DCR), sobrevida livre de progressão (SLP), sobrevida global (SG) e segurança1.
|
Response to T-DXd in Patients With HER2-Mutant mNSCLC |
||
|
Response Assessment by BICR |
T-DXd 5.4 mg/kg Once Every 3 Weeks |
T-DXd 6.4 mg/kg Once Every 3 Weeks |
|
Confirmed ORR, No. (%) |
50 (49.0) |
28 (56.0) |
|
95% CI |
39.0 to 59.1 |
41.3 to 70.0 |
|
Best confirmed overall response, No. (%) |
||
|
CR |
1 (1.0) |
2 (4.0) |
|
PR |
49 (48.0) |
26 (52.0) |
|
SD |
45 (44.1) |
18 (36.0) |
|
PD |
4 (3.9) |
2 (4.0) |
|
Nonevaluablea |
3 (2.9) |
2 (4.0) |
|
DCR, No. (%) |
95 (93.1) |
46 (92.0) |
|
95% CI |
86.4 to 97.2 |
80.8 to 97.8 |
|
DoR, months, median (95% CI) |
16.8 (6.4 to NE) |
NE (8.3 to NE) |
|
TTIR, months, median (range) |
1.8 (1.2-7.0) |
1.6 (1.2-11.2) |
|
Follow-up, months, median (range) |
11.5 (1.1-20.6) |
11.8 (0.6-21.0) |
|
Abbreviations: BICR, blinded independent central review; CR, complete response; DCR, disease control rate; DoR, duration of response; mNSCLC, metastatic non–small-cell lung cancer; NE, not estimable; ORR, objective response rate; PD, progressive disease; PR, partial response; SD, stable disease; T-DXd, trastuzumab deruxtecan; TTIR, time to initial response. aThree patients were nonevaluable at 5.4 mg/kg (one patient never received treatment because of COVID-19; two patients discontinued before first tumor assessment); two patients were nonevaluable at 6.4 mg/kg (discontinued because of adverse event before first tumor assessment). Adaptado de: Goto K, et al. J Clin Oncol. 2023;41:4852-4863 |
||
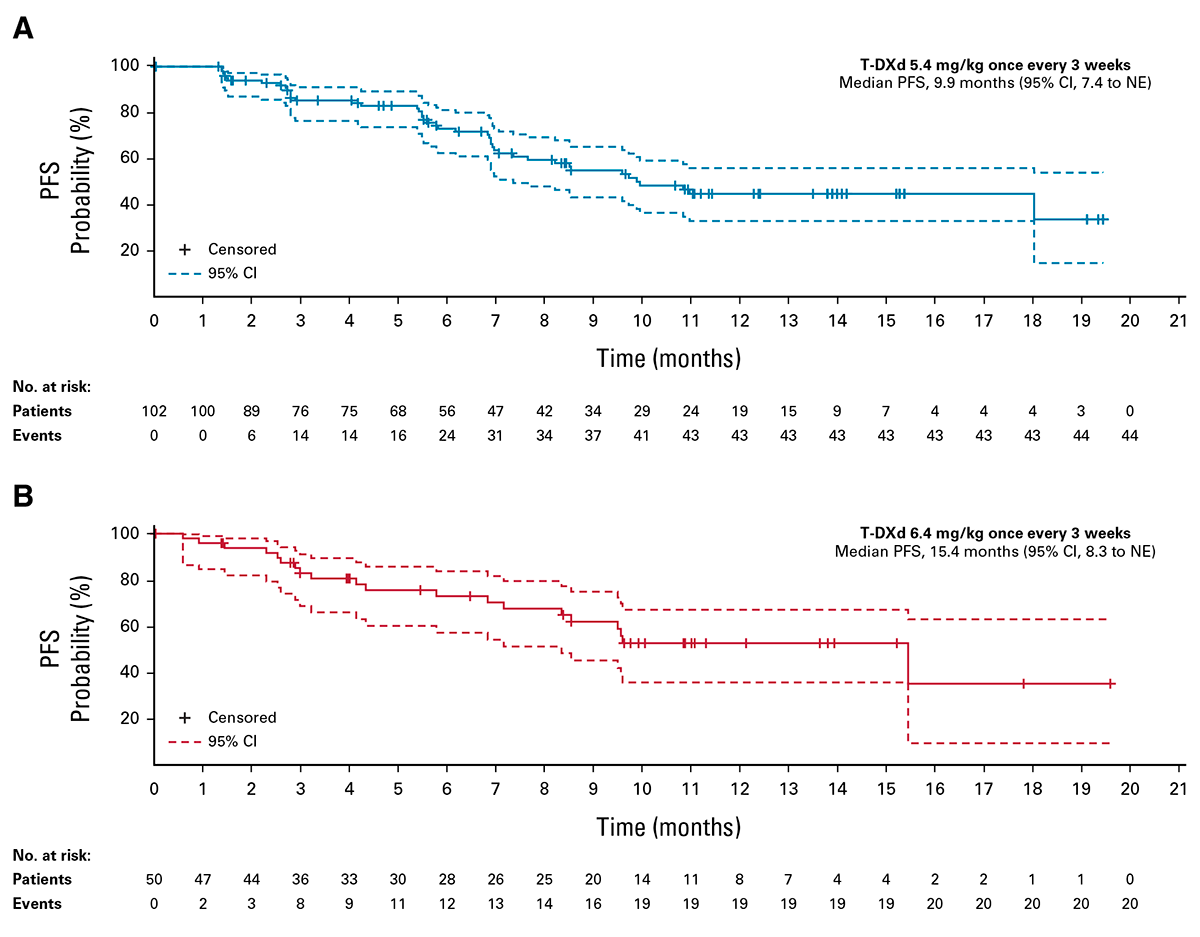 Adaptado de: Goto K, et al. J Clin Oncol. 2023;41:4852-4863
Adaptado de: Goto K, et al. J Clin Oncol. 2023;41:4852-4863
Resultados
Cento e cinquenta e dois pacientes foram randomizados na proporção 2:1 para receber T-DXd 5,4 (n=102) ou 6,4 mg/kg (n=50) uma vez a cada 3 semanas. No cutoff de dados (23 de dezembro de 2022), a duração média do acompanhamento foi de 11,5 meses (variação de 1,1 a 20,6) com T-DXd 5,4 mg/kg e 11,8 meses (variação de 0,6 a 21,0) com T-DXd 6,4 mg/kg. A ORR confirmada foi de 49,0% (95% IC, 39,0 a 59,1) e 56,0% (95% IC, 41,3 a 70,0) e a duração mediana de resposta foi de 16,8 meses (95% IC, 6,4 para não estimável [NE]) e NE (95% IC, 8,3 para NE) com 5,4 e 6,4 mg/kg, respectivamente. A duração média do tratamento foi de 7,7 meses (intervalo de 0,7-20,8) com 5,4 mg/kg e 8,3 meses (intervalo de 0,7-20,3) com 6,4 mg/kg1.
Os dados dos endpoints secundários também foram animadores, com trastuzumabe deruxtecana demonstrando uma mediana de SLP de 9,9 meses e 15,4 meses nos braços de 5,4 mg/kg e 6,4 mg/kg, respectivamente, conforme avaliado pelo BICR. No momento da análise, uma mediana de sobrevida global de 19,5 meses foi alcançada no braço de 5,4 mg/kg e não alcançada no braço de 6,4 mg/kg1.
Antitumor activity of T-DXd in patients with HER2-mutant metastatic non–small-cell lung cancer by HER2 mutation status and prior therapy 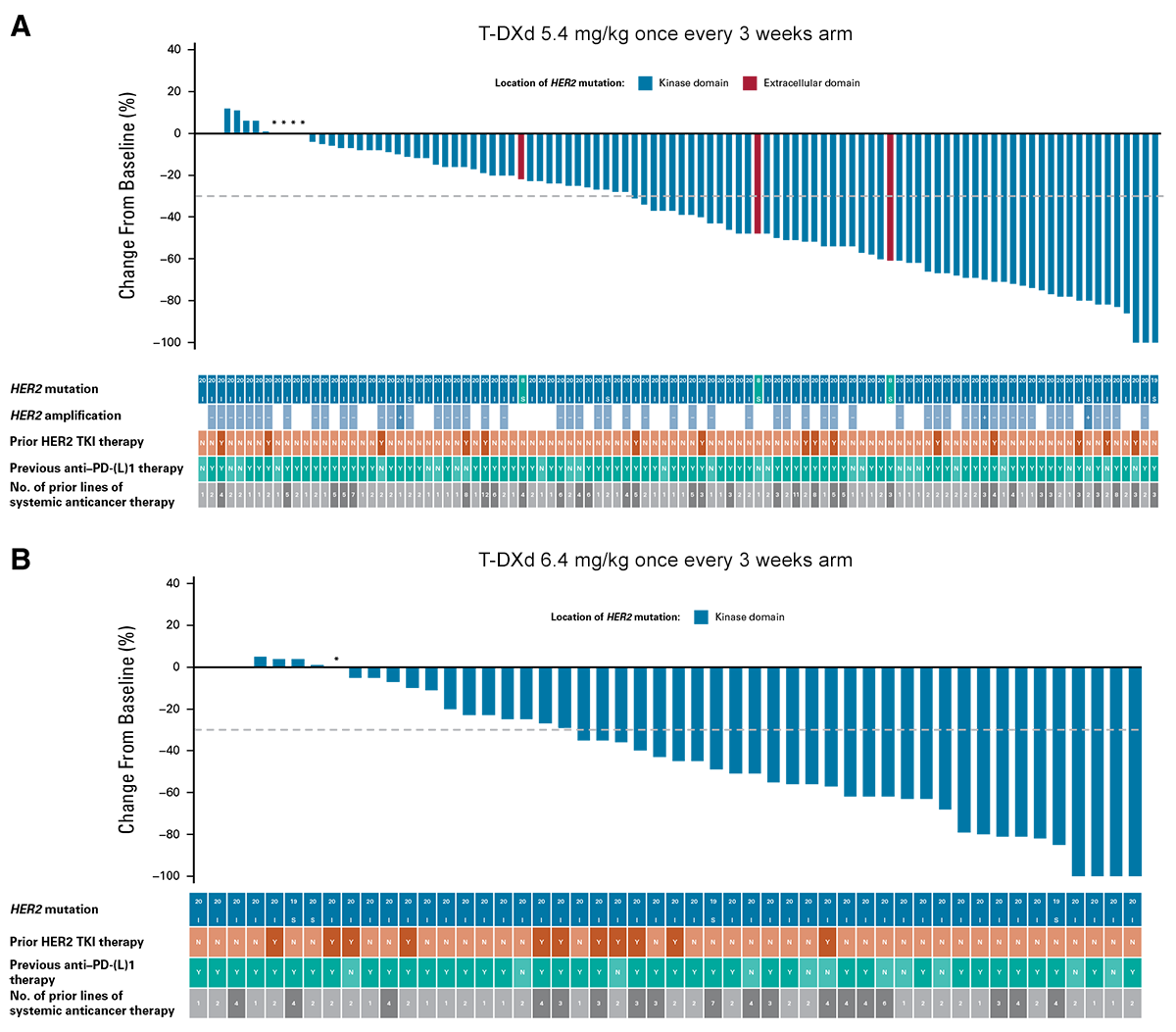 Adaptado de: Goto K, et al. J Clin Oncol. 2023;41:4852-4863
Adaptado de: Goto K, et al. J Clin Oncol. 2023;41:4852-4863
Eventos adversos relacionados ao tratamento de grau ≥ 3 ocorreram em 39 de 101 (38,6%) recebendo T-DXd 5,4 mg/kg e 29/50 pacientes (58,0%) recebendo T-DXd 6,4 mg/kg. Os eventos adversos de grau 3 ou superior mais comuns foram neutropenia (18,8% (5,4 mg/kg); 36,0% (6,4 mg/kg)) e anemia (10,9% (5,4 mg/kg); 16,0% (6,4 mg/kg)). 13 de 101 (12,9%) e 14 de 50 (28,0%) pacientes tinham doença pulmonar intersticial relacionada a medicamentos (2,0% grau ≥ 3 em cada braço) com 5,4 e 6,4 mg/kg, respectivamente.
Em conclusão, T-DXd demonstrou respostas clinicamente significativas em ambas as doses, que foram consistentes independentemente do tipo de mutação HER2 e status de amplificação, metástase basal no sistema nervoso central e tratamento prévio. O perfil de segurança foi aceitável e geralmente administrável, favorecendo T-DXd 5,4 mg/kg em comparação com T-DXd 6,4 mg/kg.
“Os resultados do DESTINY-Lung02 mostraram que T-DXd se mostrou efetivo independentemente da dose, mas com um perfil de toxicidade mais favorável com a dose inferior, de 5,4 mg/kg a cada 3 semanas”, observa De Marchi.
O oncologista William Nassib William Jr., Líder Nacional de Oncologia Torácica do grupo Oncoclínicas, destaca que esse estudo confirma o papel de trastuzumabe deruxtecana para essa população de pacientes com câncer de pulmão de células não pequenas e mutação de HER2. “Certamente essa alta taxa de resposta traz benefícios para os nossos pacientes, uma população que provavelmente não respondem muito bem a outros tratamentos. O estudo também sedimenta a dose de 5.4mg/kg a cada 3 semanas como a dose ideal, com manutenção da eficácia e redução de efeitos colaterais, incluindo redução na taxa de pneumonite”, conclui.
Assista ainda sobre o mesmo tema:
DESTINY-Lung02: T-DXd no CPCNP com mutação HER2
Apresentado no WCLC 2023, o estudo DESTINY-Lung02 confirmou a eficácia e menor toxicidade de trastuzumabe deruxtecana administrado na dose de 5,4 mg/kg a cada 3 semanas em pacientes com câncer de pulmão de células não pequenas não escamoso irressecável e/ou metastático com mutação HER2 (HER2m) previamente tratados. Os resultados estão em pauta na TV ONCONEWS, em vídeo com a participação dos oncologistas William Nassib William Jr. e Pedro De Marchi. Assista.
Referências:
- K. Goto, Y. Goto, T. Kubo, K. Ninomiya, S-W. Kim, D. Planchard, M-J. Ahn, E.F. Smit, A.J. de Langen, M. Pérol, E. Pons-Tostivint, S. Novello, H. Hayashi, J. Shimizu, D-W. Kim, K. Pereira, F-C. Cheng, A. Taguchi, Y. Cheng, P. Janne. Trastuzumab Deruxtecan in Patients With HER2-Mutant Metastatic Non–Small-Cell Lung Cancer: Primary Results From the Randomized, Phase II DESTINY-Lung02 Trial. J Clin Oncol. 2023 Sep 11. DOI: 10.1200/JCO.23.01361. Epub ahead of print. PMID: 37694347. https://ascopubs.org/doi/abs/10.1200/JCO.23.01361
- Li BT, Smit EF, Goto Y, Nakagawa K, Udagawa H, Mazières J, Nagasaka M, Bazhenova L, Saltos AN, Felip E, Pacheco JM, Pérol M, Paz-Ares L, Saxena K, Shiga R, Cheng Y, Acharyya S, Vitazka P, Shahidi J, Planchard D, Jänne PA; DESTINY-Lung01 Trial Investigators. Trastuzumab Deruxtecan in HER2-Mutant Non-Small-Cell Lung Cancer. N Engl J Med. 2022 Jan 20;386(3):241-251. doi: 10.1056/NEJMoa2112431. Epub 2021 Sep 18. PMID: 34534430; PMCID: PMC9066448. https://www.nejm.org/doi/full/10.1056/NEJMoa2112431
- US- FDA. FDA grants accelerated approval to fam-trastuzumab deruxtecan-nxki for HER2-mutant non-small cell lung cancer. Disponível em: https://www.fda.gov/drugs/resources-information-approved-drugs/fda-grants-accelerated-approval-fam-trastuzumab-deruxtecan-nxki-her2-mutant-non-small-cell-lung
- Mini Bula
|
ENHERTU® (trastuzumabe deruxtecana). INDICAÇÕES: Câncer de mama: tratamento de pacientes adultos com câncer de mama HER2-positivo metastático ou não ressecável, que tenham recebido um regime de tratamento baseado em anti-HER2 no cenário metastático, ou no cenário neoadjuvante ou adjuvante, e que desenvolveram recorrência da doença durante ou dentro de 6 meses após a conclusão do tratamento. Tratamento de pacientes adultos com câncer de mama HER2 de baixa expressão (IHC 1+ ou IHC 2+/ISH-) metastático ou não ressecável que tenham recebido uma terapia sistêmica prévia no cenário metastático, ou que desenvolveram recorrência da doença durante ou dentro de 6 meses após a conclusão de quimioterapia adjuvante. Pacientes com câncer de mama HER2 de baixa expressão com receptor hormonal positivo (RH+) devem também ter recebido ou ser inelegíveis a terapia endócrina. Câncer de pulmão: tratamento de pacientes adultos com câncer de pulmão de não pequenas células (CPNPC) não ressecável ou metastático cujos tumores tenham mutações HER2 (ERBB2) ativadoras e que tenham recebido uma terapia sistêmica prévia. Câncer gástrico: tratamento de pacientes adultos com adenocarcinoma gástrico ou da junção gastroesofágica (JGE) localmente avançado ou metastático HER2-positivo que receberam regime anterior à base de trastuzumabe. CONTRAINDICAÇÕES: hipersensibilidade ao trastuzumabe deruxtecana ou a qualquer dos componentes da formulação. CUIDADOS E ADVERTÊNCIAS: casos de doença pulmonar intersticial (DPI) e/ou pneumonite foram relatados com ENHERTU®. Os pacientes devem ser orientados a relatar imediatamente no caso de tosse, dispneia, febre e/ou qualquer novo sintoma ou piora de sintomas respiratórios, e devem ser monitorados para sinais ou sintomas de DPI / pneumonite. Casos de neutropenia, incluindo neutropenia febril foram relatados nos estudos clínicos de ENHERTU®. O hemograma completo deve ser monitorado antes do início do tratamento com ENHERTU® e antes de cada dose, conforme clinicamente indicado. Redução da fração de ejeção de ventrículo esquerdo (FEVE) é observada com terapias anti-HER2. A FEVE deve ser avaliada antes do início do tratamento com ENHERTU® e em intervalos regulares durante o tratamento, conforme clinicamente indicado. Categoria de risco na gravidez: D. A administração de ENHERTU® a gestantes não é recomendada e as pacientes devem ser informadas dos potenciais riscos ao feto antes de engravidarem. Mulheres que engravidarem devem imediatamente contatar seu médico. Caso uma mulher engravide durante o tratamento com ENHERTU®, ou em até sete meses após a última dose do tratamento, é recomendado monitoramento próximo. Lactação: não se sabe se ENHERTU® é excretado no leite materno humano. Como muitos fármacos são excretados no leite humano, e devido ao potencial de reações adversas graves em lactentes em aleitamento materno, as mulheres devem descontinuar a amamentação antes do início do tratamento com ENHERTU®. As mulheres podem iniciar o aleitamento sete meses após a última dose do tratamento. INTERAÇÕES MEDICAMENTOSAS: a coadministração com ritonavir aumentou a exposição do trastuzumabe deruxtecana em 19% e do inibidor da topoisomerase I livre em 22%. Não é necessário ajuste de dose durante a administração concomitante de ENHERTU® com medicamentos inibidores da OATP1B ou CYP3A. Não é esperada interação clinicamente significativa com medicamentos inibidores da P-gp, MATE2-K. MRP1 ou transportadores BCRP. REAÇÕES ADVERSAS: náusea, fadiga, vômito, alopecia, constipação, redução do apetite, anemia, neutropenia, diarreia, trombocitopenia, tosse, leucopenia, pirexia. POSOLOGIA: ENHERTU® deve ser administrado em infusão intravenosa a cada 3 semanas (ciclo de 21 dias), até progressão da doença ou toxicidade não manejável. Câncer de mama: a dose recomendada é 5,4 mg/kg. Câncer de pulmão: a dose recomendada é 5,4 mg/kg. Câncer gástrico: a dose recomendada é 6,4 mg/kg. Pode ser necessária a interrupção temporária, redução de dose ou descontinuação do tratamento com ENHERTU® em decorrência de reações adversas. USO RESTRITO A HOSPITAIS. VENDA SOB PRESCRIÇÃO MÉDICA. Reg. M.S.: 1.0454.0191. Registrado por: Daiichi Sankyo Brasil Farmacêutica Ltda. Serviço de Atendimento ao Consumidor: 08000-556596. Informações adicionais à disposição da classe médica. SE PERSISTIREM OS SINTOMAS, O MÉDICO DEVERÁ SER CONSULTADO. MB_05 |
Material exclusivo para profissionais de saúde habilitados a prescrever ou dispensar medicamentos. BR-28625. 2826-552493. Abril/2024.
