A farmacêutica Daiichi Sankyo, com sede no Japão e presença em mais de 20 países, amplia sua participação também no Brasil, agora que a oncologia brasileira passa a ser importante objetivo estratégico da companhia. A meta é alcançar 40% de crescimento em 2022 e nos próximos anos conquistar a liderança, confiante no compromisso com pesquisa e pipeline.
Constituída em setembro de 2005, a asiática Daiichi Sankyo reflete a aliança de duas companhias centenárias - a Sankyo e a Daiichi Pharmaceuticals - em uma das maiores operações de fusão da indústria farmacêutica. Hoje presente em 27 países, com 14 centros de pesquisa e desenvolvimento em 8 países, a companhia colhe os resultados de uma nova geração de agentes para o tratamento do câncer. “Todo o foco da empresa tem migrado para o desenvolvimento de novas moléculas em oncologia”, explica a médica Gabriela Prior, Diretora de Assuntos Médicos e Acesso ao Mercado da Daiichi Sankyo Brasil. “A partir de 2022, o maior foco de crescimento da Daiichi Sankyo no Brasil é a oncologia”, reforça.
|
A empresa começou a atuar no Brasil na década de 60, então como Luitpold Produtos Farmacêuticos, e nos anos 90 foi comprada pela Sankyo, com um portifólio bem estabelecido nas áreas de Cardiologia, Neurologia e Ortopedia. Em 2006, a companhia se fortaleceu ainda mais no País com a constituição da Daiichi Sankyo Brasil, com foco na pesquisa, desenvolvimento, fabricação e venda de medicamentos.
No pipeline, o esforço de desenvolvimento se mantém bastante focado nos ADCs, os anticorpos droga conjugados, que tem na molécula trastuzumabe deruxtecana (Enhertu®) seu principal carro-chefe. O investimento em desenvolvimento continua alto. “Somente com trastuzumabe deruxtecana temos 12 estudos da série DESTINY no mundo - do DESTINY-Breast01 até o DESTINY-Breast012”, prossegue Gabriela. “No Brasil, vamos saltar de dois estudos clínicos para 11”, ilustra a diretora médica. A nova molécula é resultado da parceria da Daiichi Sankyo com a farmacêutica AstraZeneca, mas o pipeline da oncologia vai além, incluindo ainda outros anticorpos conjugados. O objetivo é transformar ciência em valor para os pacientes, com a expectativa de colher tanto os frutos do ambiente de pesquisa, quanto os resultados de vida real.
 |
Nosso foco tem migrado para o desenvolvimento de novas moléculas em onco |
Com 15 mil colaboradores ao redor do mundo, o grupo se destaca como Inovador Farmacêutico Global e muito dessa evolução já se traduz em novas realidades para os pacientes. “O foco em oncologia vem para somar, para agregar valor, pensando que vencemos muitas doenças infectocontagiosas, conseguimos controlar as cardiovasculares e no mundo todo o câncer ainda continua como importante causa de morte. A Daiichi Sankyo quer mostrar sua responsabilidade social com respostas concretas a esse desafio global, através de uma pesquisa robusta, que atenda ao maior número possível de pacientes, reafirmando seu maior valor institucional, que é melhorar a vida das pessoas”, conclui Gabriela.
TIMELINE: CONSTRUINDO O FUTURO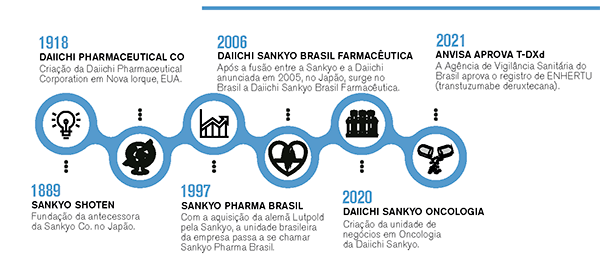
Assista também: Reframing Oncology
Em um bate-papo com o oncologista Romualdo Barroso, do Hospital Sírio-Libanês Brasília, a médica Gabriela Prior, Diretora de Assuntos Médicos e Acesso ao Mercado da Daiichi Sankyo Brasil, fala sobre os planos de expansão da companhia no País, em ano que marca investimentos expressivos e promete movimentar o ambiente de pesquisa clínica. “No Brasil, vamos saltar de dois estudos clínicos para 11 em 2022”, ressalta. “Nesse momento da oncologia toda a comunidade médica vive um grande entusiasmo pelos dados de eficácia dessa molécula”, afirma o oncologista Romualdo Barroso. Assista, na TV Onconews.
Leia mais:
1 - Anvisa aprova trastuzumabe deruxtecana no tratamento do câncer de mama avançado
2 - CMED define preço para trastuzumabe deruxtecana no tratamento do câncer de mama
3 - Anvisa amplia indicação de trastuzumabe deruxtecana no câncer de mama metastático
Mini Bula:
| ENHERTU® (trastuzumabe deruxtecana). INDICAÇÕES: tratamento de pacientes adultos com câncer de mama HER2-positivo metastático ou não ressecável, que tenham recebido dois ou mais regimes de tratamento baseados em anti-HER2. CONTRAINDICAÇÕES: hipersensibilidade ao trastuzumabe deruxtecana ou a qualquer dos componentes da formulação. CUIDADOS E ADVERTÊNCIAS: casos de doença pulmonar intersticial (DPI) e/ou pneumonite foram relatados com ENHERTU®. Os pacientes devem ser orientados a relatar imediatamente no caso de tosse, dispneia, febre e/ou qualquer novo sintoma ou piora de sintomas respiratórios, e devem ser monitorados para sinais ou sintomas de DPI / pneumonite. Casos de neutropenia, incluindo neutropenia febril foram relatados nos estudos clínicos de ENHERTU®. O hemograma completo deve ser monitorado antes do início do tratamento com ENHERTU® e antes de cada dose, conforme clinicamente indicado. Redução da fração de ejeção de ventrículo esquerdo (FEVE) é observada com terapias anti-HER2. A FEVE deve ser avaliada antes do início do tratamento com ENHERTU® e em intervalos regulares durante o tratamento, conforme clinicamente indicado. Categoria de risco na gravidez: D. A administração de ENHERTU® a gestantes não é recomendada e as pacientes devem ser informadas dos potenciais riscos ao feto antes de engravidarem. Mulheres que engravidarem devem imediatamente contatar seu médico. Caso uma mulher engravide durante o tratamento com ENHERTU®, ou em até sete meses após a última dose do tratamento, é recomendado monitoramento próximo. Lactação: não se sabe se ENHERTU® é excretado no leite materno humano. Como muitos fármacos são excretados no leite humano, e devido ao potencial de reações adversas graves em lactentes em aleitamento materno, as mulheres devem descontinuar a amamentação antes do início do tratamento com ENHERTU®. As mulheres podem iniciar o aleitamento sete meses após a última dose do tratamento. INTERAÇÕES MEDICAMENTOSAS: a coadministração com ritonavir aumentou a exposição do trastuzumabe deruxtecana em 19% e do inibidor da topoisomerase I livre em 22%. Não é necessário ajuste de dose durante a administração concomitante de ENHERTU® com medicamentos inibidores da OATP1B ou CYP3A. Não é esperada interação clinicamente significativa com medicamentos inibidores da P-gp, MATE2-K. MRP1 ou transportadores BCRP. REAÇÕES ADVERSAS: náusea, fadiga, vômito, alopecia, constipação, redução do apetite, anemia, neutropenia, diarreia, trombocitopenia, tosse, leucopenia e cefaleia. POSOLOGIA: a dose recomendada é 5,4 mg/kg, administrada em infusão intravenosa a cada 3 semanas (ciclo de 21 dias), até progressão da doença ou toxicidade não manejável. Pode ser necessária a interrupção temporária, redução de dose ou descontinuação do tratamento com ENHERTU® em decorrência de reações adversas. USO RESTRITO A HOSPITAIS. VENDA SOB PRESCRIÇÃO MÉDICA. Reg. M.S.: 1.0454.0191. Farm. Responsável: Dr. Pedro de Freitas Fiorante – CRF-SP 76.376. Registrado por: Daiichi Sankyo Brasil Farmacêutica Ltda. Serviço de Atendimento ao Consumidor: 08000-556596. Informações adicionais à disposição da classe médica. MB_01. |
