 Em mais um tópico da coluna ‘Drops de Genômica’, o oncologista André Murad discute a relação da metilação do DNA com o câncer.
Em mais um tópico da coluna ‘Drops de Genômica’, o oncologista André Murad discute a relação da metilação do DNA com o câncer.
Por André Marcio Murad*
Já na década de 1980, os pesquisadores observaram que as células tumorais apresentavam níveis muito mais baixos de metilação do que as células normais derivadas do mesmo tecido. Pesquisas subsequentes correlacionaram mudanças complexas nos padrões de metilação do DNA ao câncer. Esses estudos demonstraram que a hipometilação genômica é uma propriedade de todos os cânceres examinados até o momento.
A hipometilação do DNA reverte o silenciamento de genes, levando à transcrição irrestrita de muitos conjuntos de genes – incluindo aqueles associados ao desenvolvimento de câncer. Também relaxa o controle sobre os genes impressos, fazendo com que as células adquiram novas propriedades de crescimento. A hipometilação de sequências de DNA repetitivas em regiões heterocromáticas aumenta os rearranjos cromossômicos e as mudanças no número de cromossomos, ambos característicos das células cancerígenas.
Embora as células cancerosas sejam caracterizadas por hipometilação global, regiões selecionadas de seu genoma são hipermetiladas quando comparadas às células normais. A hipermetilação seletiva de ilhas CpG associadas ao promotor silencia certos genes, incluindo genes supressores de tumor, muitas vezes de uma forma específica do tumor. A análise desses padrões fornece uma maneira de identificar tipos e subtipos de tumor e prever os locais para os quais o tumor pode metastatizar. Por exemplo, a região promotora do gene de câncer de mama BRCA1 é hipometilada em células normais, mas é hipermetilada e inativada em muitos casos de câncer de mama e ovário. Em outro exemplo, o silenciamento do gene de reparo de DNA MLHI por hipermetilação é um passo fundamental no desenvolvimento de algumas formas de câncer de cólon. MLH1 ilustra como as epimutações podem estar envolvidas na formação do tumor, isoladamente ou em combinação com alterações genéticas.
De fato, o câncer agora é visto como uma doença que geralmente resulta do acúmulo de alterações genéticas e epigenéticas. Por exemplo, em uma linhagem de células de câncer de bexiga, um alelo de um gene supressor de tumor, CDKN2A, é mutado e o outro alelo normal é silenciado por hipermetilação. Como ambos os alelos são inativados (embora por mecanismos diferentes), as células podem escapar do controle do ciclo celular e se dividir continuamente. Ainda mais impressionante, no câncer de ovário, as mutações em nove genes específicos são predominantes, mas a hipermetilação do promotor é observada em 168 genes. Esses genes são silenciados epigeneticamente, e sua expressão reduzida está ligada ao desenvolvimento e manutenção desse câncer.
O amplo padrão de hipermetilação observado nas células cancerosas e as muitas funções dos genes afetados sugerem que esse fenômeno pode resultar de uma desregulação generalizada do processo de metilação, em vez de um evento direcionado.
Atualmente, muitos dos mecanismos que causam alterações epigenéticas nas células tumorais não são bem compreendidos, em parte porque as alterações ocorrem muito cedo na conversão de uma célula normal em cancerosa, e também porque no momento em que o câncer é diagnosticado, já ocorreram alterações nos padrões de metilação. O gene de reparo de DNA MLH1, por exemplo, desempenha um papel importante na estabilidade do genoma, e o silenciamento desse gene por hipermetilação causa instabilidade em sequências repetitivas de microssatélites, o que, por sua vez, é um passo importante no desenvolvimento do câncer de cólon e vários outros cânceres. Em alguns indivíduos com câncer de cólon, o promotor MLH1 em células normais do cólon já é silenciado por hipermetilação, indicando que esse evento epigenético ocorre muito cedo na formação do tumor antes do desenvolvimento de mutações genéticas a jusante.
Em suma, várias linhas de evidência apoiam o papel das alterações epigenéticas no câncer:
1. A hipometilação global pode causar instabilidade genômica e alterações cromossômicas em grande escala que são uma característica do câncer.
2. Mecanismos epigenéticos podem substituir mutações como forma de silenciar genes supressores de tumor individuais ou ativar oncogenes.
3. As modificações epigenéticas podem silenciar vários genes, tornando-os mais eficazes na transformação de células normais em células malignas do que mutações sequenciais de genes únicos.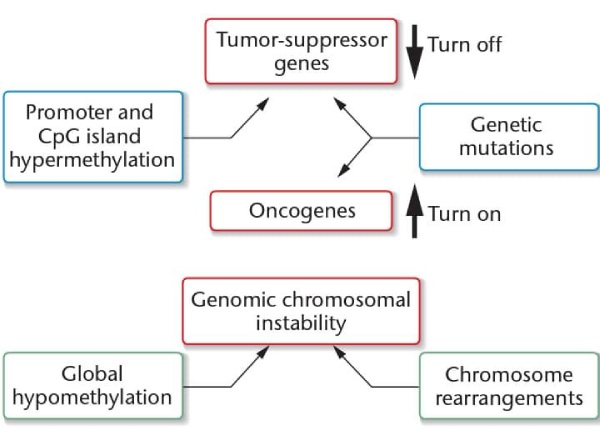
*André Murad é diretor científico do Grupo Brasileiro de Oncologia de Precisão (GBOP), diretor clínico da Personal - Oncologia de Precisão e Personalizada, professor adjunto coordenador da Disciplina de Oncologia da Faculdade de Medicina da UFMG, e oncologista e oncogeneticista da CETTRO Oncologia (DF)








