 O oncologista Luiz Alberto Mattos (foto), professor do Departamento de Medicina Clínica e chefe do Serviço de Oncologia do Hospital das Clínicas da Universidade Federal de Pernambuco, e acadêmicos de medicina da instituição, abordam em artigo a síndrome de lise tumoral. O trabalho inaugura a série de artigos de atualização científica sobre Emergências em Oncologia do Onconews.
O oncologista Luiz Alberto Mattos (foto), professor do Departamento de Medicina Clínica e chefe do Serviço de Oncologia do Hospital das Clínicas da Universidade Federal de Pernambuco, e acadêmicos de medicina da instituição, abordam em artigo a síndrome de lise tumoral. O trabalho inaugura a série de artigos de atualização científica sobre Emergências em Oncologia do Onconews.
 O oncologista Luiz Alberto Mattos (foto), professor do Departamento de Medicina Clínica e chefe do Serviço de Oncologia do Hospital das Clínicas da Universidade Federal de Pernambuco, e acadêmicos de medicina da instituição, abordam em artigo a síndrome de lise tumoral. O trabalho inaugura a série de artigos de atualização científica sobre Emergências em Oncologia do Onconews.
O oncologista Luiz Alberto Mattos (foto), professor do Departamento de Medicina Clínica e chefe do Serviço de Oncologia do Hospital das Clínicas da Universidade Federal de Pernambuco, e acadêmicos de medicina da instituição, abordam em artigo a síndrome de lise tumoral. O trabalho inaugura a série de artigos de atualização científica sobre Emergências em Oncologia do Onconews.
*Luiz Alberto de Mattos1, Aline Gomes da Silva2, Manuela Maria de Amorim Borba2, Maria Eduarda Lima Vidal2
Introdução
A síndrome de lise tumoral pode ser definida como um distúrbio metabólico decorrido da liberação em massa de componentes intracelulares a partir da lise de células tumorais. É frequentemente desencadeada pelo uso de agentes citotóxicos em tratamentos como quimioterapia, podendo, no entanto, também ocorrer espontaneamente (síndrome da lise tumoral espontânea), sobretudo em doenças malignas linfoproliferativas.
A liberação aguda desses componentes intracelulares, como ácido úrico, fosfatos e potássio compromete a homeostase, podendo evoluir clinicamente com quadros de arritmia cardíaca, falência renal aguda, convulsões ou até óbito, o que classifica esta síndrome como uma emergência oncológica.
Historicamente, a síndrome de lise tumoral foi associada a neoplasias hematológicas de alto grau, a exemplo da leucemia, linfoma e mielomas múltiplos (Belay et al, 2017), porém estudos recentes demonstram que alguns tumores sólidos com alto turnover celular também apresentam risco para desenvolvimento do quadro. Fatores de risco como volume de doença, sensibilidade do tumor à quimioterapia, níveis elevados de DHL, envolvimento da medula óssea e estado do paciente, como acometimento renal, devem ser levados em consideração quando há suspeita da síndrome.
Fisiopatogenia
A fisiopatogenia da síndrome de lise tumoral provém da liberação maciça para o meio extracelular de componentes presentes no interior das células neoplásicas através da morte espontânea ou mediada pelo uso de terapia antineoplásica.
Como as células neoplásicas são ricas em componentes como purinas, fosfatos e potássio, o aumento abrupto da concentração dessas substâncias no meio extracelular provocará um distúrbio na homeostase corporal, acarretando quadros de hipercalemia, hiperfosfatemia, hipocalcemia e hiperuricemia, que tendem a aparecer em torno de 24 a 48 horas após o início do tratamento. Essas alterações metabólicas terão repercussões em órgãos diversos, especialmente coração e rins.
A hipercalemia provocada pela liberação maciça do potássio intracelular representa uma manifestação laboratorial típica da síndrome de lise tumoral. O aumento anômalo desse íon no compartimento extracelular é responsável por alterações na musculatura esquelética e cardíaca que são observadas clinicamente como arritmias cardíacas severas, alterações no eletrocardiograma e fadiga. Essa condição tende a aparecer de forma mais rápida que as demais – cerca de 12 a 24 horas após o início das terapias – pois ocorre um extravasamento precoce do potássio em consequência da diminuição dos níveis de ATP em virtude do estresse metabólico provocado pela quimio e radioterapia (Tallo et al, 2013).
A elevação dos níveis de purinas, representadas pela adenina e guanina, provenientes do material nucleico da célula maligna e seu consequente metabolismo a ácido úrico será responsável por acarretar a hiperuricemia. Esta condição culmina em lesão renal aguda devido à deposição de cristais nos túbulos renais por consequência da baixa solubilidade dos uratos.
O grande extravasamento de fosfato da célula neoplásica sobrecarrega o mecanismo de excreção renal deste íon, provocando a hiperfosfatemia. Esse aumento nos níveis basais de fosfato promove a precipitação do mesmo com o cálcio nos túbulos renais, o que provoca tanto a hipocalcemia devido ao consumo do cálcio no complexo com o fosfato quanto agravamento do quadro de lesão renal supracitado.
A hipocalcemia, por sua vez, é responsável pelo surgimento de sintomas de cunho neurológico, como alteração do estado de consciência, tetania e convulsões, assim como de alterações cardíacas, a exemplo da arritmia.
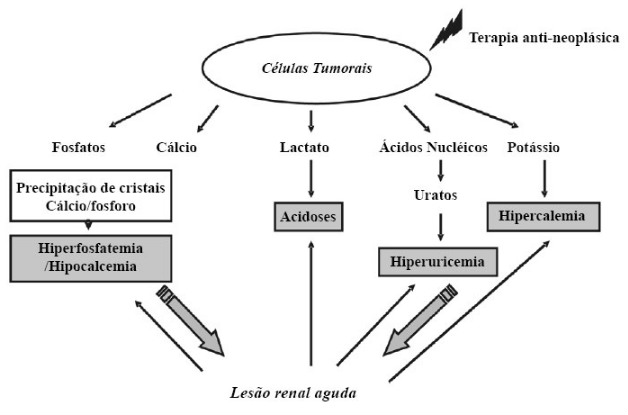 Figura 1. Fisiopatogenia da lesão renal aguda na síndrome de lise tumoral. Fonte: DARMON, Michael; MALAK, Sandra; GUICHARD, Isabelle; SCHLEMMER, Benoit. Síndrome de lise tumoral: uma revisão abrangente da literatura. Rev. Bras. Ter. Intensiva, 2008.
Figura 1. Fisiopatogenia da lesão renal aguda na síndrome de lise tumoral. Fonte: DARMON, Michael; MALAK, Sandra; GUICHARD, Isabelle; SCHLEMMER, Benoit. Síndrome de lise tumoral: uma revisão abrangente da literatura. Rev. Bras. Ter. Intensiva, 2008.
Fatores de risco
Fatores relacionados ao paciente como hipotensão, desidratação, nefropatia prévia com oligúria ou urina ácida aumentam a chance de desenvolvimento da síndrome da lise tumoral. Além disso, fatores relacionados ao tamanho do tumor, como volume tumoral, envolvimento da medula óssea, fase da terapia (sobretudo no início) com seu efeito citotóxico também contribuem para a evolução do quadro.
Diagnóstico
Para realizar o diagnóstico da síndrome da lise tumoral, pode-se fazer uso de dados colhidos na anamnese para construir a hipótese, a exemplo do tempo do início dos sintomas (geralmente de 48 a 72 horas depois do início do tratamento do câncer), presença de sintomas abdominais (distensão e dor), urinários (disúria, hematúria), sintomas de hipercalemia, como fraqueza e paralisia muscular, sintomas de hipocalcemias, como náuseas, convulsões, alterações do nível da consciência, espasmos, arritmias, síncopes, letargia e edemas, sintomas indicativos de lesão renal aguda (uremia) e sinais de deposição de fosfato de cálcio (prurido, artrite, irite e gangrenas).
Um perfil bioquímico e ácido-básico deve ser traçado para avaliação dos valores e condução do manejo: níveis séricos de sódio, cloro, fosfato, potássio, bicarbonato, ácido úrico, creatinina, desidrogenase láctica e gasometrias, devem ser colhidos. Exames de imagem podem ser necessários para investigação de complicações, a exemplo da lesão renal aguda. O monitoramento cardíaco e avaliação do débito urinário também podem ser fortes aliados na condução do processo.
Segundo Cairo e Bishop (2004), para definição da síndrome da lise tumoral laboratorial é necessário encontrar ao menos três dos seguintes critérios, até sete dias após o início do tratamento do câncer: 1) Ácido úrico ≥ 8mg/dL ou 25% maior que o valor basal; 2) Potássio ≥ 6 mEq/L ou 25% maior que o valor basal; 3) Fosfato ≥ 4,5 mg/dL em adultos, > 6,5 mg/dL em criança ou 25% maior que a linha de base; 4) Cálcio ≤ 7 mg/dL ou 25% menor que o valor basal.
Para definição da síndrome da lise tumoral clínica, é necessário presença dos critérios laboratoriais com uma ou mais complicações clínicas (arritmia cardíaca, morte súbita, convulsões, oligúria ou aumento de 0,3mg/dl de creatinina).
Prevenção e tratamento
Para realizar a prevenção da síndrome da lise tumoral é de fundamental importância a estratificação do risco do paciente, bem como as comorbidades por ele apresentadas. Dessa forma, devido à maior chance de depleção volêmica nessa síndrome, indivíduos que apresentem moderado risco e alto risco devem iniciar uma hidratação agressiva com solução salina isotônica. Tal reposição hídrica elevará o volume intravascular, a taxa de filtração glomerular e o volume urinário, resultando na diminuição da concentração dos solutos. Aliado a isso, deve-se realizar profilaxia farmacológica antes de iniciar a quimioterapia e a radioterapia.
O tratamento da síndrome está direcionado para a resolução dos distúrbios metabólicos causados. Em relação, à hiperuricemia, inicia-se com a administração de hidratação rigorosa seguido o esquema de 3L/m2 para manter a elevação do débito urinário, inibindo o depósito de ácido úrico e fosfato de cálcio nos túbulos renais, sendo necessário o monitoramento do balanço hídrico a cada 6 horas.
Em relação aos fármacos que podem ser utilizados, há a rasburicase, que é uma enzima que atua degradando o ácido úrico, diminuindo seus níveis sanguíneos e formando alantoína, que é mais solúvel. Esse medicamento deve ser ofertado para crianças e pacientes de alto risco, sendo contraindicado para portadores de deficiência de glicose-6-fosfato desidrogenase (G6PD). Tal contraindicação se dá já que as hemácias dos indivíduos com essa deficiência apresentam fraca resposta ao estresse oxidativo, que pode ser produzido pelo peróxido de hidrogênio resultante da metabolização do ácido úrico.
Outra opção, que está indicada para pacientes com baixo risco e moderado risco, seria a administração do alopurinol, que impede a transformação da xantina e da hipoxantina em ácido úrico, sem agir, entretanto, no ácido úrico já formado. Porém, tanto a xantina quanto a hipoxantina, que estarão com seus níveis sistêmicos elevados, apresentam baixas solubilidades podendo levar a uma nefropatia e a uma diminuição na depuração de quimioterápicos, o que pode exigir diminuição das doses da quimioterapia.
Pode-se pensar ainda na utilização do método de alcalinização da urina, que estaria relacionado com o aumento da excreção de ácido úrico, entretanto, essa ação reduz a solubilidade do fosfato de cálcio, aumentando sua precipitação e diminuindo a solubilidade da xantina. Dessa forma, desde diretrizes de 2008 para o tratamento da síndrome de lise tumoral, não representa uma orientação formal.
Já na hiperfosfatemia, observa-se melhora com o tratamento para hiperuricemia, que aumenta a excreção renal de fosfato. Pode-se ainda recomendar uma dieta restritiva em relação ao fosfato. Em contrapartida, o tratamento da hipocalcemia deve ser realizado apenas em casos sintomáticos, através da reposição de cálcio por gluconato de cálcio.
No que diz respeito à hipercalemia, é necessário que haja monitoração cardíaca devido aos riscos de arritmias. Se houver presença de arritmias ou alterações eletrocardiográficas sugestivas de hipercalemia, administra-se gluconato de cálcio, que estabiliza as membranas dos miócitos cardíacos. Além disso, pode-se injetar insulina para realizar translocação de potássio pelo cálcio intracelular. Outro fármaco que pode ser utilizado é a furosemida, que atua a nível da alça de Henle, inibindo a reabsorção de potássio, devendo, entretanto, ser utilizado com cautela, pois pode acelerar a cristalização do ácido úrico.
Quando, a despeito da hidratação, o paciente não apresentar melhora imediata ou evoluir para um quadro de lesão renal aguda, deve-se iniciar a terapia de substituição renal, que permitirá tanto o controle metabólico quanto a proteção renal durante a síndrome. O padrão mais adequado de acordo com alguns estudos seria diálise diária prolongada ou diálise sequencial isolada seguida por hemofiltração contínua.
Referências:
TALLO, Fernando Sabia; VENDRAME, Leticia Sandre; LOPES, Renato Delascio; LOPES, Antonio Carlos. Síndrome da lise tumoral: uma revisão para o clínico. Rev. Bras. Clin. Med. São Paulo, abr-jun 2013.
BELAY, Yohannes; YIRDAW, Ketsela; ENAWGAW, Bamlaku. Tumor lysis sydrome in patients with hematological malignancies. Journal of Oncology, vol. 2017.
DARMON, Michael; MALAK, Sandra; GUICHARD, Isabelle; SCHLEMMER, Benoit. Síndrome de lise tumoral: uma revisão abrangente da literatura. Rev. Bras. Ter. Intensiva, 2008.
STRAUSS, Penelope; HAMLIN, Shannan K. Tumor lysis syndrome: a unique solute disturbance. Nursing clinics of North America, jun. 2017.
CAIRO, Mitchell S.; BISHOP, Michael. Tumor lysis syndrome: new therapeutic strategies and classification. British Journal of Haematology, 2004, 127, 3-7.
Autores: 1 - Luiz Alberto de Mattos é Professsor do Depto. de Medicina Clínica e Chefe do serviço de Oncologia do Hospital das Clínicas da Universidade Federal de Pernambuco;
2 - Aline Gomes da Silva, Manuela Maria de Amorim Borba e Maria Eduarda Lima Vidal são acadêmicos de medicina da Universidade Federal de Pernambuco








