 Vanessa Dybal (foto), oncologista do grupo de mama da clínica AMO (Assistência Multidisciplinar em Oncologia), em Salvador, e coordenadora do Centro de Pesquisa Clínica ÉTICA, comenta três trabalhos em câncer de mama que mereceram destaque na ASCO 2016: os estudos MA.17 e PALOMA 2, que abordaram o tratamento de manejo hormonal, e o estudo PHEREXA, que avaliou o bloqueio duplo em segunda linha para a doença HER2 positiva.
Vanessa Dybal (foto), oncologista do grupo de mama da clínica AMO (Assistência Multidisciplinar em Oncologia), em Salvador, e coordenadora do Centro de Pesquisa Clínica ÉTICA, comenta três trabalhos em câncer de mama que mereceram destaque na ASCO 2016: os estudos MA.17 e PALOMA 2, que abordaram o tratamento de manejo hormonal, e o estudo PHEREXA, que avaliou o bloqueio duplo em segunda linha para a doença HER2 positiva.
 Vanessa Dybal (foto), oncologista do grupo de mama da clínica AMO (Assistência Multidisciplinar em Oncologia), em Salvador, e coordenadora do Centro de Pesquisa Clínica ÉTICA, comenta três trabalhos em câncer de mama que mereceram destaque na ASCO 2016: os estudos MA.17 e PALOMA 2, que abordaram o tratamento de manejo hormonal, e o estudo PHEREXA, que avaliou o bloqueio duplo em segunda linha para a doença HER2 positiva.
Vanessa Dybal (foto), oncologista do grupo de mama da clínica AMO (Assistência Multidisciplinar em Oncologia), em Salvador, e coordenadora do Centro de Pesquisa Clínica ÉTICA, comenta três trabalhos em câncer de mama que mereceram destaque na ASCO 2016: os estudos MA.17 e PALOMA 2, que abordaram o tratamento de manejo hormonal, e o estudo PHEREXA, que avaliou o bloqueio duplo em segunda linha para a doença HER2 positiva.
{jathumbnail off}*Por Vanessa Dybal
MA.17
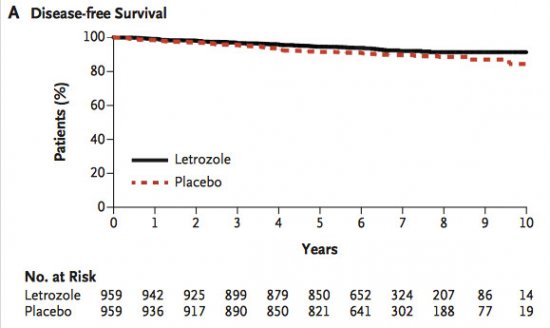
Apresentado na sessão plenária por Paul Goss, o estudo MA.17 é um estudo de fase 3, randomizado, placebo controlado, que aborda o uso da terapia adjuvante extendida com inibidor da aromatase por até 10 anos. O estudo randomizou 1918 mulheres pós-menopausadas com diagnóstico de câncer de mama receptor hormonal positivo tratadas previamente de forma adjuvante com tamoxifeno seguido por inibidores de aromatase por 4,5 a 6 anos para uso adicional de 5 anos de letrozol 2,5mg ou placebo. O objetivo primário do estudo foi sobrevida livre de doença, e os secundários sobrevida global, incidência de câncer de mama contralateral, qualidade de vida e toxicidade a longo prazo.
A taxa de aderência ao tratamento foi de 62,5% e 62,3% para os grupos em uso de letrozol e placebo, respectivamente, e o seguimento mediano foi de 6,3 anos.
O estudo atingiu o endpoint primário, com taxa de sobrevida livre de doença em 5 anos de 95% para o grupo de tratamento contra 91% para o grupo placebo, com um p = 0,01 e uma redução de risco de 33% (HR = 0,66 com IC 95% 0,48 - 0,91). Tal benefício foi consistente em todos os subgrupos pré-estratificados, incluindo status linfonodal, tratamento prévio com quimioterapia, intervalo entre última dose do inibidor de aromatase e a randomização e duração do tratamento prévio com tamoxifeno.
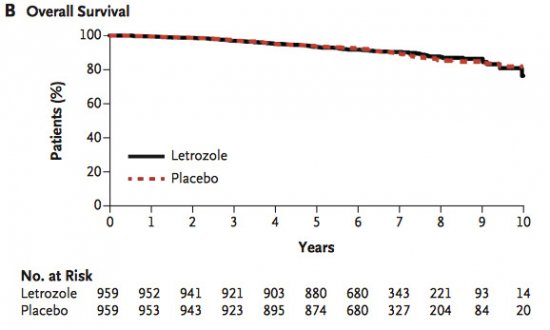
Não foram observadas diferenças de sobrevida global entre os grupos (93% x 94%, p=0,83 com IC 0,73 - 1,28). A taxa de risco para recidiva local, contralateral ou morte com o uso do letrozol comparado com placebo foi 0,79 (p=0,05 com IC de 0,63 - 1,00).
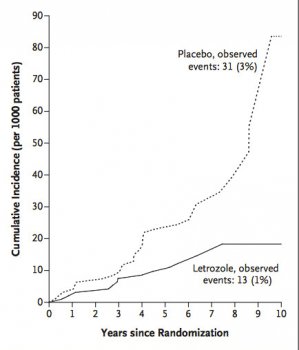
A incidência anual de carcinoma contralateral da mama foi de 0,21% x 0,49%, favorecendo o braço de tratamento (p = 0,007 com 95% IC 0,22 - 0,81).
Poucas pacientes descontinuaram o tratamento por toxicidade; 5,4% no grupo letrozol x 3,7% no placebo.
Apesar do uso de suplemetação de cálcio, vitamina D e bisfosfonados terem sido igualmente distribuídos entre letrozol e placebo, o desenvolvimento de osteoporose, com T score menor que -2,5 na densitometria óssea foi maior no grupo do inibidor da aromatase (10% x 7%, p=0,03), além de maior número de fraturas neste grupo (14% x 9%; p= 0,001).
Sintomas atribuídos à deprivação hormonal como fogachos, atralgias, mialgias e fadiga não foram diferentes entre os grupos, assim como a qualidade de vida, que foi reportada detalhadamente em estudo em separado (MA.17R).
O artigo foi disponibilizado on line pelo New England Journal of Medicine no mesmo dia da apresentação.
Considerando-se que o risco de recidiva à distância e óbito pela doença nas pacientes em terapia de bloqueio hormonal reduzem progressivamente com o decorrer dos anos, é justificado o achado do ganho em recidiva local/contralateral mamária e não em sobrevida global, dado o longo período de tratamento prévio. Tal benefício, nas várias discussões durante o simpósio e em editoriais posteriores, foi comparado aos encontrados nos estudos de terapia preventiva para pacientes de alto risco.
Cabe ainda ressaltar que a grande maioria das pacientes pós-menopausadas sob terapia adjuvante de bloqueio hormonal da nossa prática diária iniciam o tratamento com inibidor da aromatase sem uso prévio de tamoxifeno, o que as torna diferentes da população do estudo e, portanto, com benefício incerto desta estratégia.
A diminuição da massa óssea no grupo do letrozol e aumento no grupo placebo, após a suspensão do uso prévio da droga, eram esperados e alertam para a necessidade de monitoramento ativo e uso de medidas profiláticas/terapêuticas adequadas, reportadas no estudo como acima de 46% (bisfosfonatos) e de 84% (cálcio e vitamina D) em ambos os grupos.
A inesperada boa aceitação e baixa toxicidade em relação aos sintomas comumente atribuídos ao uso de inibidores da aromatase pode ser em parte atribuída a um auto-viés de seleção por parte das participantes do estudo, que não apresentando queixas importantes durante os anos prévios de terapia, aceitaram o prolongamento do seu uso.
PALOMA 2
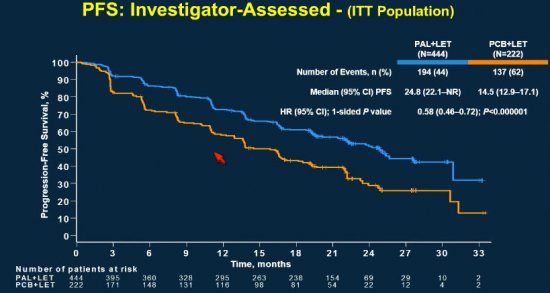
Apresentado por Dennis Slamon, o de fase 3 PALOMA 2 randomizou pacientes pós-menopausadas com neoplasias de mama avançada ER positivo/HER2 negativo, sem tratamento prévio, para o uso de letrozol (2,5mg ao dia) com palbociclibe (125mg ao dia por 3 semanas consecutivas com 1 semana de descanso) versus letrozol (2,5mg ao dia) com placebo. Foram randomizadas 666 pacientes no esquema 2:1. O objetivo primário foi a sobrevida livre de progressão pelo investigador; e os secundários incluíram taxa de resposta, sobrevida global, toxicidades, biomarcadores e auto-avaliação do paciente. A mediana de acompanhamento foi de 23 meses.
Confirmando os dados do PALOMA 1, o grupo da associação mostrou um aumento da sobrevida livre de progressão de 14,5 meses para 24,8 meses ( p<0,000001 com HR = 0,58; 95% IC 0,46 - 0,72). O ganho foi consistente em todos os subgrupos analisados.
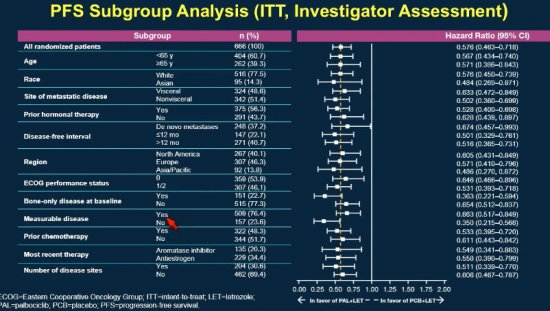
A taxa de resposta também foi significativamente maior no grupo do letrozol com palbociclibe, avaliados tanto pelo observador quanto pelo paciente.
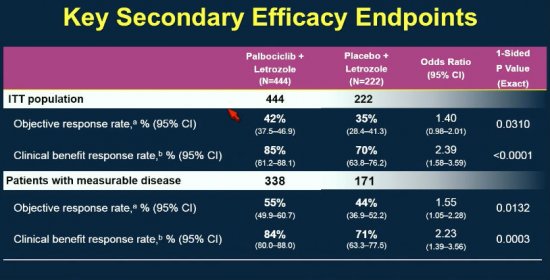
Cerca de 93% da dose de palbociclibe foi administrada, sendo a neutropenia a principal toxicidade determinante de reduções de dose: 80% das pacientes apresentaram em neutropenia de todos os graus, sendo 66% graus 3 e 4.
Os resultados do PALOMA 2 vieram corroborar as recomendações do recentemente publicado guideline da ASCO para o tratamento de bloqueio hormonal do câncer de mama receptor hormonal positivo. A terapia de manejo hormonal sequencial deve ser a preferencial no tratamento da doença metastática hormônio dependente, excetuando-se situações de doença visceral ameaçadora de vida. A escolha deve ser baseada no tipo de tratamento adjuvante recebido, no intervalo para a recidiva e na reserva visceral.
Nas paciente comprovadamente menopausadas, o uso de inibidores de aromatase devem ser considerados como tratamento inicial, associados ou não ao palbociclibe. Na progressão aos inibidores da aromatase, tanto o tratamento com fulvestranto na dose de 500mg, associado ou não ao palbociclibe, quanto o examestano associado ao everolimus são opções terapêuticas.
Apesar de vários estudos em em andamento, infelizmente ainda não possuímos marcadores preditores de resposta clinicamente validados para o auxílio na escolha da estratégia a ser utilizada.
No tratamento adjuvante das pacientes pós-menopausadas, o uso de inibidor de aromatase por 5 anos ainda é o recomendado, existindo agora a possibilidade para o seu uso extendido por 10 anos naquelas pacientes que toleraram bem a terapia e fizeram uso prévio de tamoxifeno. Não fica obrigatório, no entanto, o uso de 15 anos de terapia de bloqueio hormonal para todas as pacientes.
PHEREXA
Na doença HER2 positiva, o estudo PHEREXA investigou o uso de pertuzumabe com trastuzumabe e capecitabina em comparação ao trastuzumabe e capecitabina para pacientes que progrediram a uma linha de tratamento com quimioterapia + trastuzumabe.
De janeiro de 2010 a agosto de 2013 foram incluídas 452 pacientes, analisadas em maio de 2015. As doses habituais de trastuzumabe e pertuzumabe foram utilizadas no estudo, porém a dose de capecitabina diferiu entre os grupos, sendo de 1250mg/m2 no grupo sem pertuzumabe e de 1000mg/m2 no grupo do bloqueio duplo.
O objetivo primário do estudo foi a análise da sobrevida livre de progressão centralmente avaliada, e os endpoints secundários incluíram a sobrevida global, sobrevida livre de progressão avaliada pelo investigador, toxicidades e análise de biomarcadores.
Assim como no estudo CLEOPATRA, a minoria das pacientes (27% e 24%) havia recebido trastuzumabe no tratamento adjuvante ou neoadjuvante, porém 73% e 76% receberam o medicamento na primeira linha de tratamento da doença metastática.
O estudo foi desenhado inicialmente para ser de fase 2, com um HR previsto de 0,75 e uma diferença de sobrevida livre de progressão mínima de 2,1 meses para ser considerado positivo. Com a divulgação dos dados positivos de primeira linha, o estudo foi ampliado para fase 3.
O objetivo primário do estudo não foi alcançado, encontrando uma diferença entre os grupos de 2,1 meses para a sobrevida livre de progressão, com HR = 0,82 (IC 0,65 - 1,02), consistente em todos os subgrupos pré-estratificados. Apesar de numericamente positivo para a sobrevida global (36,1 meses x 28,1 meses, com HR 0,68 e IC 0,51 - 0,90), este dado não pôde ser considerado relevante devido ao teste ser hierarquicamente atrelado à positividade do endpoint primário do estudo.
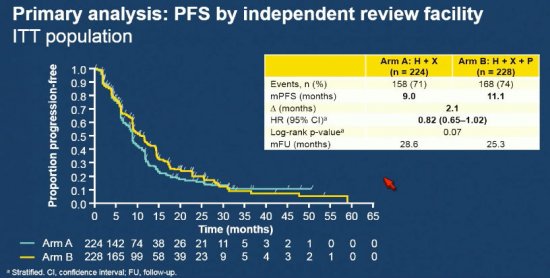
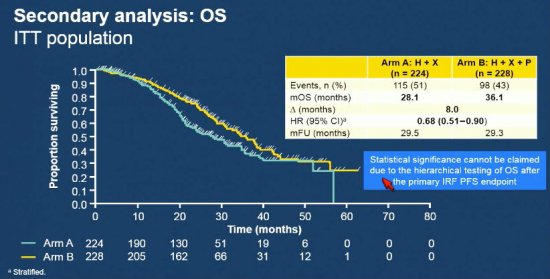
Apesar da existência de estudos prévios de fase 2 positivosem linhas avançadas com o uso de pertuzumbe, os dados apresentados pelo PHEREXA, associado aos dados de custo efetividade da droga, sugerem que esta estratégia ainda não seja recomendada em outro cenário que não o tratamento inicial das pacientes com câncer de mama HER-2 positivos.
*Vanessa Dybal é oncologista do grupo de mama e coordenadora do Centro de Pesquisa Clínica ÉTICA da clínica AMO (Assistência Multidisciplinar em Oncologia), em Salvador, Bahia.








